RESEARCH
イモリの再生と赤血球の不思議な関係
イモリは四肢や尾などを失っても元通りに再生することができる。しかも1度きりではない。歳をとってもくり返し再生できるのだ。イモリが進化の過程で独自に獲得したこのしくみを網羅的な遺伝子解析から追うと、これまで知られていなかった再生と血液の関わりが見えてきた。
1.イモリがもつ「例外的」で「高度」な再生能力
有尾両生類の仲間であるイモリ(Newt:註1)は、中生代白亜紀の後期(およそ9,000万年前)にサンショウウオの一種から進化した動物群であり、その現生種のほとんどは新生代(およそ6,500万年前以降)に現れたと考えられている。ヒトを含む四肢動物(4本足の脊椎動物)の共通祖先はおよそ3億6,000万年前に出現したと予測されており、イモリは進化の歴史の中でも比較的最近、地球上に出現した動物群と言える。
イモリは四肢や尾だけでなく、脳や心臓の一部、眼のレンズ(水晶体)や網膜など、体の様々な部分を失っても完璧に再生できる。もっとも水性期(胚、幼生、胎児)の四肢動物は多かれ少なかれ、同様の能力をもっている(図1)。ただしこの能力は通常陸生期になると大きく減退していくのだが、イモリは例外的に歳をとっても何度でもくり返し再生できるところに特徴がある。この事実は、18世紀にイタリアの博物学者Lazzaro Spallanzani(ラザロ・スパランツァーニ)によって発見されて以来、多くの研究者によって検証されてきた。1970年代に岡田節人、江口吾朗らは、こうしたイモリの卓越した再生能力が細胞の脱分化によって支えられていることを、レンズ再生の研究で示した。私たちは近年、網膜と肢の再生でも脱分化が起きていることを見出した。成体のイモリが肢を失うと未分化な細胞が集合したふくらみ(再生芽)ができ再生が始まるのだが、この未分化細胞は、組織を構成していた筋肉や骨がいったんその特徴を失った(脱分化した)ものなのである。一方、水性期の再生を支えているのは幹細胞(註2)である。脱分化型の再生は陸生期に減退する幹細胞型の再生を補うしくみとして、イモリが進化の過程で独自に獲得したものだと私たちは考えている。
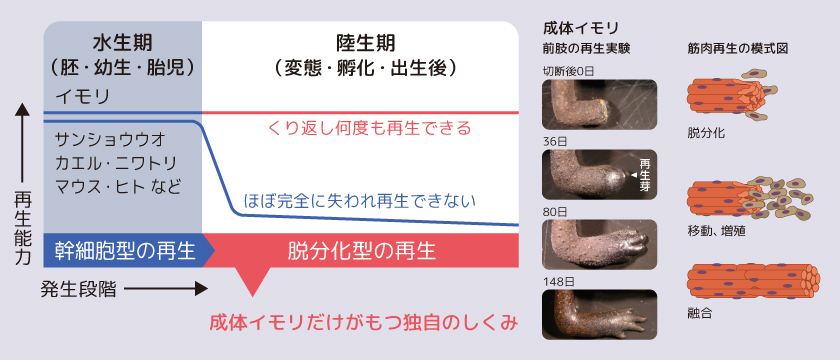
(図1) イモリの例外的で高度な再生能力
一般に四肢動物の一生は水中で生活する期間(水生期)と陸上で生活する期間(陸生期)に分けられる。イモリは例外的に陸生期に入った後も高い再生能力を維持することができる。この脱分化型の再生について筋肉を例に示した(右図)。筋肉は多数の細胞が融合した多核細胞だが、切断されると切断面から核をひとつだけもつ細胞が分離される(この現象を脱分化とよぶ)。脱分化細胞が移動と増殖をくり返し、最終的に再び細胞が融合し筋肉が再生する。(写真出典:Tanaka et al., Nature Communications. 7:11069, 2016より改変)
(註1) イモリ Newt
イモリとは有尾両生類イモリ科(Salamandridae)に属す少数の動物群を指す。欧米では有尾両生類一般やサンショウウオのことを‘Salamander(サラマンダー)’と呼ぶ。我が国ではSalamander をイモリともサンショウウオとも訳すことがあるので注意が必要だ。
(註2) 幹細胞
分裂して自分と同じ細胞をつくる能力(自己複製能)と、別の種類の細胞に分化する能力(多分化能)を合わせもつ細胞。分化能力の異なる様々な幹細胞が存在する。受精卵は個体のすべての細胞へと分化可能な分化全能性の幹細胞である。
2.イモリ独自の能力を遺伝子解析から探る - Newtic1の発見
成体イモリがもつ高度な再生能力はヒトを含む脊椎動物が共通にもつ遺伝子のはたらきで説明できるのか、それともイモリは固有の遺伝子を獲得したのか。この問題に答えるべく、アカハライモリ(Cynops pyrrhogaster)の遺伝子発現の情報を網羅するトランスクリプトーム・データベース(註3)を作製した。
そして、成体アカハライモリの肢再生に注目し、再生芽の形成に伴って発現が増える遺伝子を探索した。結局、イモリ固有の遺伝子は見つからなかったが、有尾両生類の進化過程で出現したと考えられる新奇遺伝子が一つ見つかったのでNewtic1と名付けた。私たちはこの遺伝子が細胞の脱分化を制御する、核ではたらく転写因子ではないかと予想したのだが、意外にも細胞膜に結合する膜タンパク質の遺伝子であることが明らかになった(図2)。 そこでNewtic1タンパク質を発現する細胞を丹念に調べたところ、さらに意外なことに一部の赤血球であることがわかった。
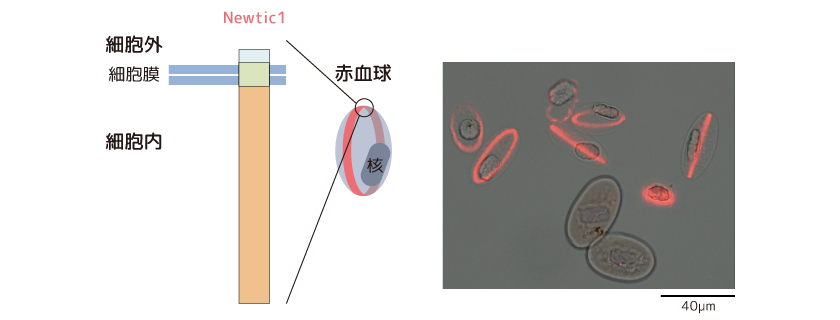
(図2) 赤血球の膜に局在するNewtic1
アミノ酸配列をもとづく構造予測からNewtic1には膜結合部位(左図:黄緑の領域)があること、その大部分(左図:オレンジの領域)は細胞質側へ向いていることがわかった。写真の赤い部分がNewtic1の局在を示している。写真の下側にある2つの成熟した赤血球はNewtic1を発現していない。(写真出典:Casco-Robles et al., Scientific Reports 8:7455, 2018より改変)
(註3) アカハライモリのトランスクリプトーム・データベース TOTAL
イモリネットワークの遺伝子情報サイトIMORI(http://antler.is.utsunomiya-u.ac.jp/imori/)で公開しており、誰でも利用することができる。
成体イモリの赤血球は、脾臓でつくられ体内を循環しながら成熟する(図3)。Newtic1は成熟途上の赤血球(polychromatic normoblast: PcNob)に特異的に発現し、そのタンパク質は細胞の縁(赤道面)に沿ってリング状に局在している。もっとも、すべてのPcNobがNewtic1を発現するわけではない。酸素を運ぶ能力の発達とは連動せず、いずれの発達段階でも25-30%に発現している。
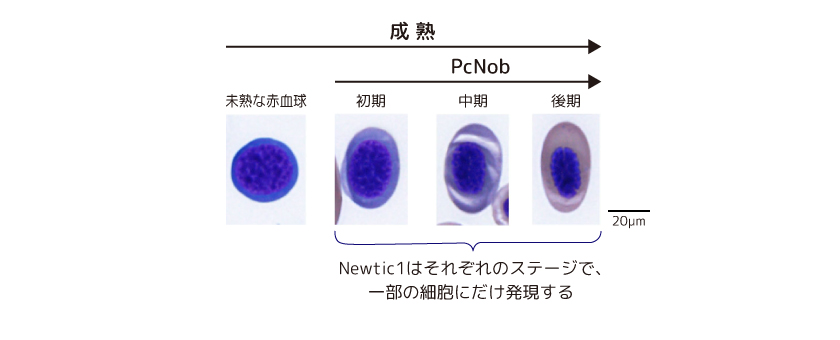
(図3) 全身を循環しながら成熟するイモリの赤血球
成体アカハライモリの循環している血液中には、未熟な赤血球や成熟過程の様々な段階の赤血球(PcNob)が観察される。写真は赤血球を血球用の色素で染めたもの(Wright-Gimsa染色)。成熟に伴い核が楕円形に凝縮し、細胞質の空間が広くなる。PcNobは後期にかけてその細胞質がオレンジ色に変化するが、これはヘモグロビンの合成(酸素運搬能の発達)が始まったことを示している。(写真出典:Casco-Robles et al., Scientific Reports 8:7455, 2018より改変)
さらにNewtic1を発現するPcNobは集合体(erythrocyte clump: EryC)を形成すること、正常な血液中でEryCは必ず単球(白血球の一種)と複合体をつくることも見出した(図4)。このEryC-単球複合体はNewtic1を発現していない単独の赤血球とともに全身を循環している。
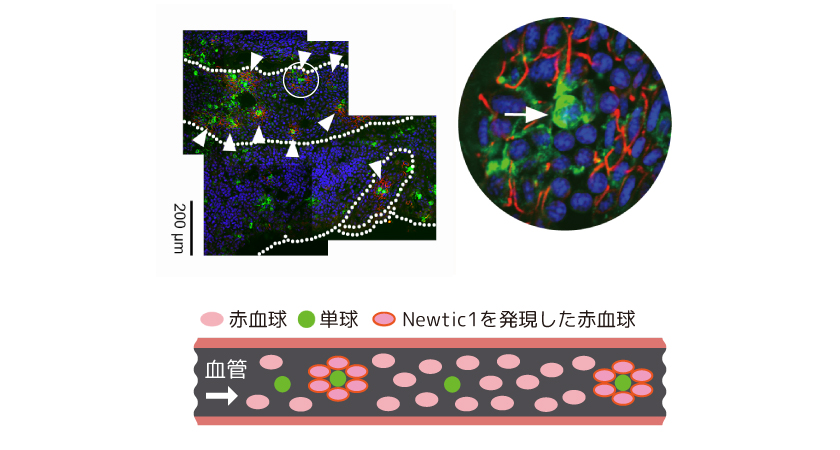
(図4) 単球とともに複合体をつくって全身を循環するNewtic1を発現した赤血球
写真は脾臓から出る動脈を撮影したもの。Newtic1を発現するPcNob(赤)が集合体をつくって循環している様子が見てとれる(矢頭)。これらの集合体は内部に必ず単球(白血球の一種:緑)を伴っている。青色に染色されているのは細胞内の核である。(写真出典:Casco-Robles et al., Scientific Reports 8:7455, 2018)
3.成長していく再生芽とNewtic1の関係は?
成体イモリの肢再生過程では傷口が閉じた頃から、切断部の組織の毛細血管中でPcNobが徐々にNewtic1を発現する。Newtic1を発現したPcNobは、EryCを形成しつつ再生芽の成長に伴い先端部に集積していくのである(図5)。このとき、EryCは再生芽に向けて伸びる新生血管の内部にあり、血管の伸長に伴って再生芽の先端部に運ばれるようだ。興味深いことに、ここで見られるEryCは単球を伴わない。正常な血液中の複合体とは異なり、Newtic1発現赤血球だけの集合体なのである。再生芽が発達し、軟骨ができる頃になると、再生芽の先端部で血管どうしが結合し、血液循環が再開する。これに伴って血液は正常血に置き換わり、結果として再生芽中のEryCの密度が減少する。幼生イモリ(水性期)で成体と同様の赤血球の存在を調べたところ、Newtic1の発現はごく稀にしか検出できないうえに、肢の再生芽の血管には存在しなかった。つまり全身を循環するEryC-単球複合体も、肢の再生芽に集積するEryCも成体イモリに特有の存在なのである。
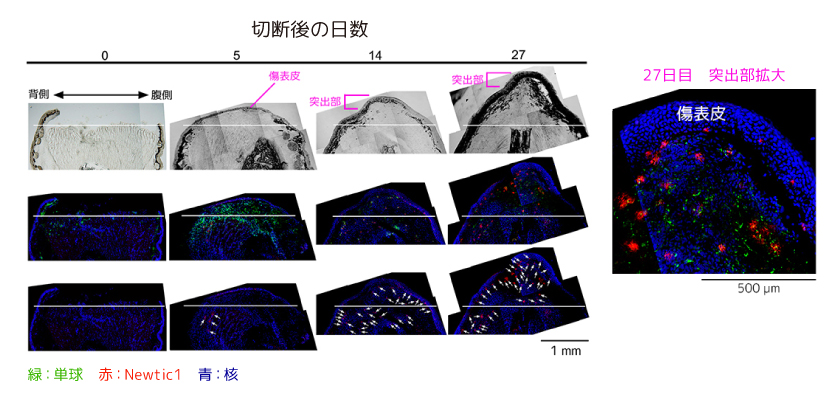
(図5) 成体イモリの肢の再生過程におけるNewtic1の発現
白い矢印は、Newtic1を発現するPcNobの集合体(EryC)を示す。(写真出典:Casco-Robles et al., Scientific Reports 8:7455, 2018より改変)
4.さまざまなタンパク質を運ぶ赤血球
EryCが再生芽の先端部に集積することから、赤血球が何らかの因子を分泌しているのではないかと考えた。イモリの赤血球には核があり、タンパク質の合成や分泌に必要な細胞内小器官が存在する。遺伝子解析の結果、PcNobには成長因子や細胞外基質分解酵素、機能未知の因子を含む数多くの分泌因子が存在することがわかった(図6)。その中には、肢の再生芽形成に必須とされるタンパク質分解酵素(メタロプロテアーゼ)や、筋細胞の脱分化に関わるとされるBMPファミリーの因子(BMP2)、イモリ固有の構造をもつ成長因子で心臓再生に関わる可能性が示唆されているnsCCNが含まれていた。すなわち、イモリの赤血球は、こうした因子を全身に運ぶ「薬のカプセル」のようなものだと考えられる。2つの成長因子(TGFβ1、BMP2)に着目して解析した結果、両因子ともEryCが再生芽の先端部に移動する過程で個々のPcNobから失われていくことがわかった。これはまさに、「薬のカプセル」から薬が放出される過程と考えられる(図7)。
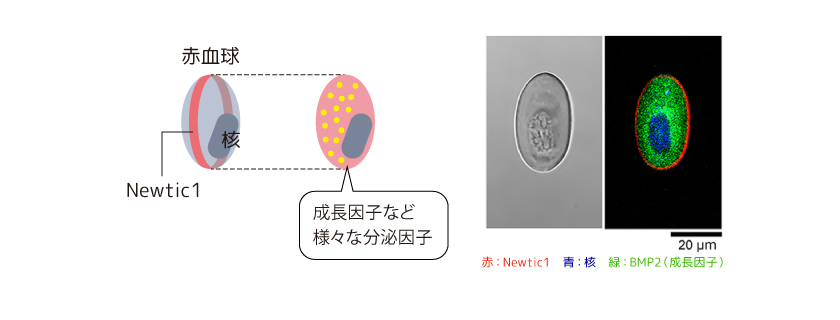
(図6) 成体イモリの赤血球の中の分泌因子
遺伝子解析の結果赤血球の内部には成長因子(TGFβ1、IGFII、BMP2、PDGFC、VEGEC、nsCCN)やメタロプロテアーゼ(Col-a、Col-b、MMP3/10、MMP9、MMP21)、その他機能未知の多数の分泌因子が含まれていることがわかった。写真は成長因子のひとつBMP2の赤血球内の局在。BMP2とTGFβ1の解析から、PcNobが含有する因子の量は、因子の種類によって異なる調節を受けていることがわかった。(写真出典:Casco-Robles et al., Scientific Reports 8:7455, 2018より改変)
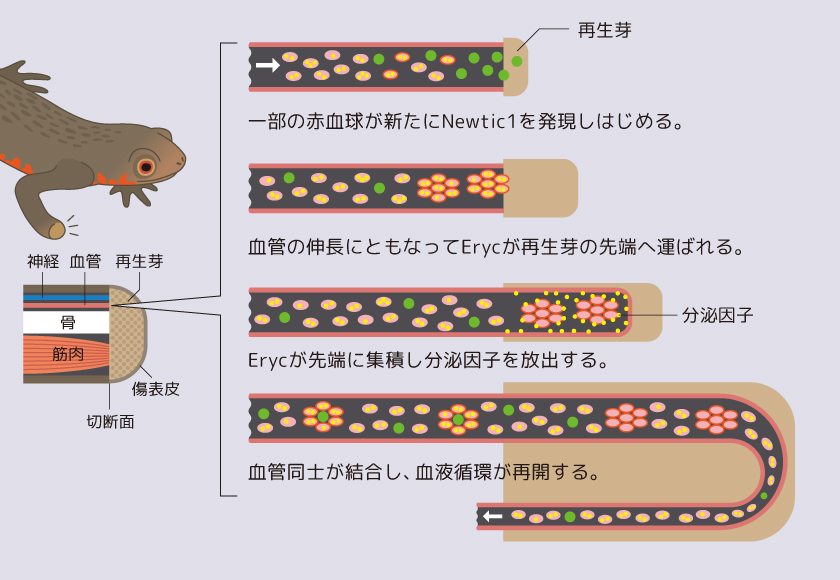
(図7) 見えてきたイモリの肢再生と赤血球の関わり
赤血球PcNobがNewtic1を発現し、EryCを形成しながら再生芽に分泌因子を運ぶ様子を示す模式図。
私たちヒトを含め、哺乳類の赤血球には核もタンパク質合成能もなく、その機能は酸素運搬しか知られていない。今回、Newtic1の発見を通して、成体イモリでは赤血球が分泌因子を介し他の細胞にはたらきかけたり、血流を整えたりすることで再生に関与している可能性が明らかになった。Newtic1はイモリ固有の遺伝子ではなかったが、成体イモリ独自の再生能力を説明する遺伝子の一つと考えてよいだろう。
今回、脱分化にかかわるイモリ固有の遺伝子は見つからなかったことから、脱分化は脊椎動物に共通の遺伝子のはたらきである可能性が高まった。私たちは今、ヒトゲノムの10倍以上もある長大なイモリゲノムの解読を進めNewtic1と赤血球内の分泌因子の機能解析とゲノム情報から、イモリの例外的で高度な再生のしくみを解明していこうと考えている。
近年の研究からイモリは進化過程で、傷ついた臓器の修復方法を線維化:せんいか/瘢痕化:はんこんか(fibrosis/scar formation)から再生へと転換したと予想されている(瘢痕:はんこん-再生転換:さいせいてんかん)。ヒトは陸生期に臓器を損傷すると傷跡を残して治癒する(瘢痕治癒:はんこんちゆ)が、イモリの場合は傷跡を残さず再生する(無瘢痕再生:むはんこんさいせい)。ヒトの場合、体が傷つくと患部がまず炎症をおこし、次いで周囲の組織から線維芽細胞がやってくる。線維芽細胞は分裂し、コラーゲンなどの線維性タンパク質を分泌して損壊部を固める。これがいわゆる線維化である。線維化は傷口をすばやく閉じることができるが、様々な弊害を伴う。例えば、皮膚などの場合には傷跡が残る(瘢痕化)。また、様々な要因により内臓組織の一部が慢性的な炎症をくり返している場合も患部は線維化し、放っておくと臓器が機能不全となって、重篤な疾患につながる。がんを発症する場合もある。瘢痕治癒に参加する線維芽細胞の由来は、臓器ごとに異なるが、主に患部周囲の間質組織:かんしつそしき(註4)に常駐する線維芽細胞と、実質組織:じっしつそしきの細胞が形質転換して生じた線維芽細胞様の細胞だ。
一方、イモリの場合は線維化や瘢痕化が起こらず、がんにもならずに、患部は元通りに再生する。こうしたイモリの無瘢痕再生の場合も参加する細胞の由来は、実質組織の細胞が脱分化して生じた線維芽細胞様の細胞と、間質組織の線維芽細胞である。ヒトの瘢痕治癒とイモリの無瘢痕再生の過程を、細胞レベルで比較するとよく似ているのである。この過程の共通点と違いを分子の言葉で語ることができれば、脱分化によるイモリ型の再生を医療に応用する路が拓けると私は考えている。今回の研究で明らかになった、成体イモリの赤血球が運ぶ因子の中には、メタロプロテアーゼという酵素が含まれている。これはコラーゲンなどの細胞外基質を分解し、再生芽へと向かう細胞の移動を助けると予測されているタンパク質だ。一つの仮説として、成体イモリでは赤血球が線維芽細胞による線維化/瘢痕化を制御することで、再生のための細胞外環境を整える役割を担うと考えることができる。このような機能はヒトの赤血球にはない。そこでイモリの赤血球が運ぶ因子の同定と機能解析を行い、再生能力と赤血球の関係解明を進めている。
また私たちは、イモリの再生研究を医療へとつなぐ研究の一つとして、イモリとマウスの皮膚の損傷修復をモデルにした瘢痕治癒と無瘢痕再生の比較を行っている。それぞれに関わる線維芽細胞の種類と行動の詳細な解析を進めているところだ。近年、組織を構成する個々の細胞の遺伝子発現を容易に比較解析できる技術が生まれている。そこで無瘢痕再生と瘢痕治癒の全過程に関わるすべての細胞の特徴づけと、様々な臓器での種間の比較を行うことができる。ここから個々の組織を再生する因子の候補リストを効率的に得て、すべての臓器に普遍的な因子を見つけたいと期待している。解析技術の進展を活用し、一歩ずつ研究を積み重ねていくつもりである。
(註4) 間質組織(かんしつそしき)
各器官の主要な機能を担う組織(実質組織(じっしつそしき))を支えたり、結合させたりする組織。

千葉 親文(ちば・ちかふみ)
1995年筑波大学大学院生物科学研究科生物物理化学専攻修了。博士(理学)。同大学大学院生命環境科学研究科講師、准教授などを経て2018年より同大学生命環境系教授。イモリ研究者で作るイモリネットワーク代表。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)