RESEARCH
腸の活発な新陳代謝を支える幹細胞とそのニッチ
腸は消化吸収と同時に危険な異物は取り込まない防御機能をもつ。腸のはたらきの大部分を担う腸管上皮は体内で最も細胞分裂速度が早く、毎日1千万個の細胞が生まれ、死んでいる。この活発な新陳代謝は、永続的な自己複製能と組織内の全ての細胞へ分化する能力とを合わせもつ、腸管上皮幹細胞によって支えられている。
1.使い捨ての分化細胞と生き続ける幹細胞
私たちの腸はからだの内部にあるが、実は外界と接しており、しかもその面積が全臓器の中で最も広い。食べたり、飲んだりしたものはもちろん、ウイルスや細菌などの異物に常にさらされている(図1)。
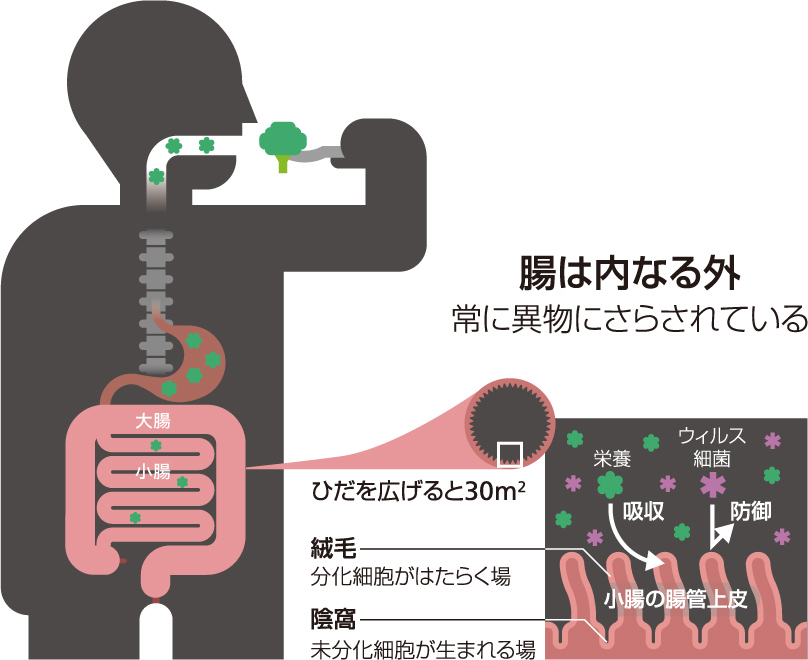
(図1) 腸管上皮の構造
腸の表面を覆う腸管上皮は吸収効率を最大限にするために、絨毯のような絨毛(じゅうもう)とくぼんだ陰窩(いんか)という構造からなる。陰窩は主に未分化な増殖細胞からなり、分化とともに細胞が絨毛へと移動していく。絨毛には3種類の分化細胞が存在し、それぞれ栄養・水分の吸収(吸収上皮細胞)、粘液を産生しバリアー形成(杯細胞)、ホルモンを産生し腸管の運動制御(内分泌細胞)に関わっている(図2)。
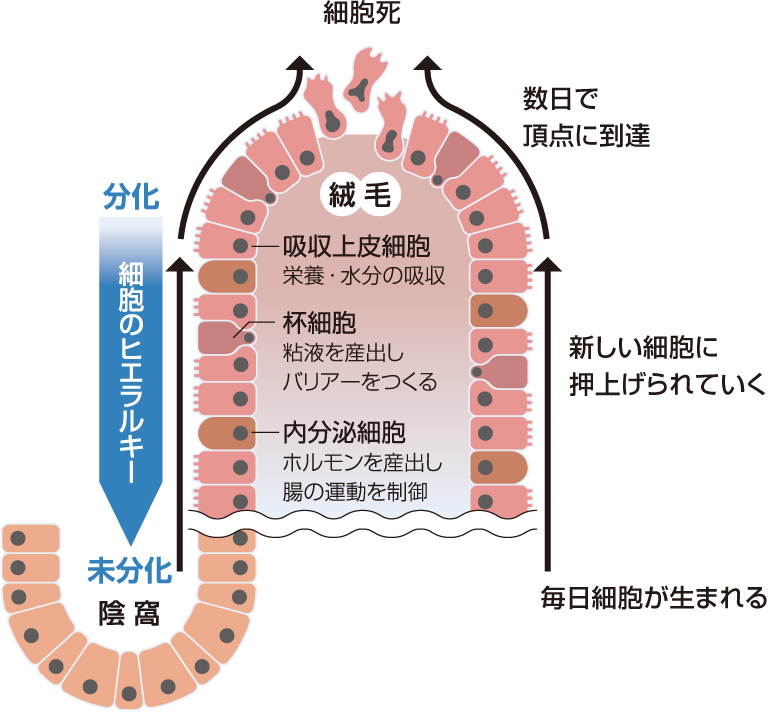
(図2) 絨毛ではたらく分化細胞
これらの細胞はいずれも非常に短命で、腸管上皮は数日でほぼ全てが新しい細胞に置き換わる。異物のストレスに常にさらされおり、細胞ががん化する危険性も高いため、絨毛の分化細胞は使い捨てとも言えるしくみになっているのだろう。一方、陰窩にはパネート細胞という抗菌タンパク質を分泌する分化細胞があり寿命が1ヶ月と長い。この細胞のはたらきについては後ほど触れる。
腸管上皮の活発な新陳代謝を支えているのが、腸管上皮幹細胞である。組織幹細胞と呼ばれ体内のさまざまな組織において、生涯自分自身を複製し続けるとともに(自己複製能)、その組織の全てのタイプの細胞に分化する(多分化能)細胞の一つである。私は、腸管上皮幹細胞が機能を発揮するしくみの研究を続けてきた。
2.真の幹細胞はどこに? 30年以上続いた議論
腸管上皮幹細胞の存在は古くから知られていたが、長い間、細胞の特定ができていなかった。その候補として陰窩の底部から数えて4番目にあってほとんど分裂しない+4 細胞と、陰窩の最底部にありパネート細胞に挟まれ活発に分裂するCBC細胞の2つが考えられていた(図3)。30年以上にわたる議論の中では、組織幹細胞はDNA複製にともなう変異の蓄積を最小限に抑えるために活発に分裂はしないという定説に基づき、+4 細胞がより有力な候補とされていた。
2007年、私が所属していたオランダの研究グループが、Lgr5という分子がCBC細胞の目印となることを見出した。そして、Lgr5を用いたCBC細胞の長期間観察と、その子孫細胞の系譜の解析とから、CBC細胞が腸管上皮幹細胞であることを証明した。その後、+4細胞の子孫細胞は、通常は分泌細胞のみなのだが、傷害などで腸管上皮幹細胞がなくなると、脱分化して腸管上皮幹細胞になる予備細胞であることがわかり、議論は終結した。
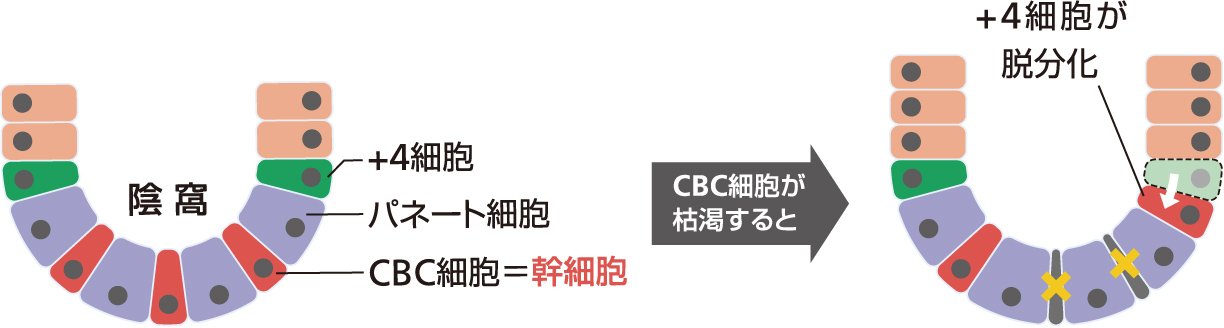
(図3) CBC細胞と+4細胞
3.腸管上皮幹細胞の機能を発揮するために必要なニッチ
幹細胞を幹細胞たらしめる環境を「幹細胞ニッチ」と呼ぶ。これまで、幹細胞はほとんど分裂せずにニッチを占拠し、厳格なヒエラルキーの頂点にあると考えられてきた(図4)。
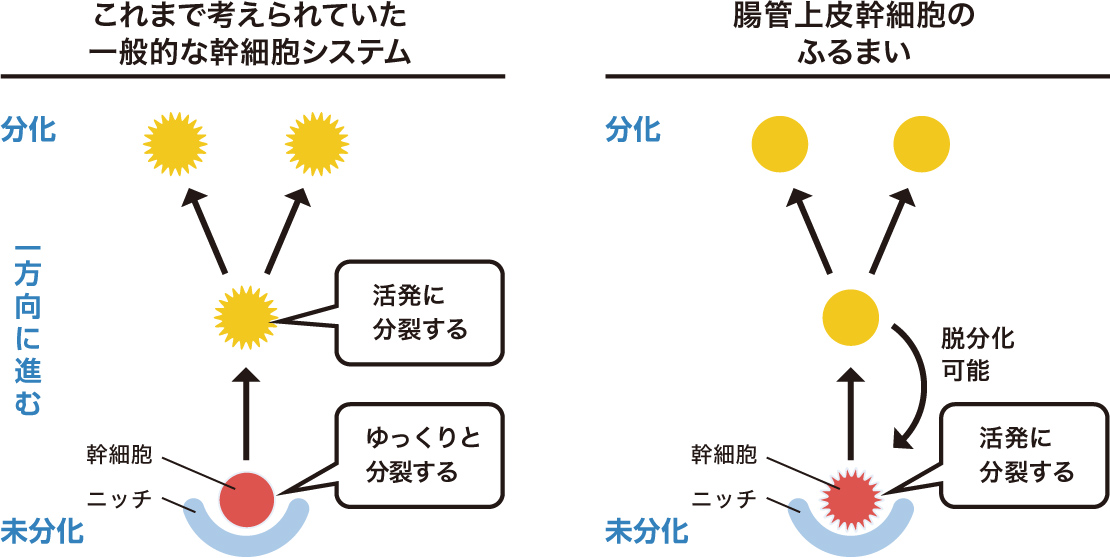
(図4) 従来考えられていたしくみとは異なる腸管上皮幹細胞のふるまい
だが、腸管上皮幹細胞は毎日分裂しており、幹細胞以外の+4 細胞が幹細胞に戻ることもできる。ここには、それまで考えられていたような厳格なしくみではなく、環境の変化に応じてヒエラルキーが変化する柔軟なしくみが存在しているようだ。それを実現している、腸管上皮幹細胞のニッチとは何なのだろう。私はニッチを人工的に再現することで、その実態を明らかにしたいと考えた。
4.ニッチの再現によりその実態を知る
腸管上皮幹細胞のニッチには、未分化状態のまま細胞を増殖させる信号(ニッチ因子)が存在するはずである。そこで、マウスの腸管上皮に存在するタンパク質の中からニッチ因子の候補を探し、それを加えた培地でのCBC細胞の培養の可否を検討した。細胞を培養するための培地は、組織内でCBC細胞が置かれている環境と近づけるために、マトリゲルと呼ばれる立体的なものを使用した。そして、2009年にニッチ因子となる3つのタンパク質を特定することができた。それらを加えたマトリゲルでCBC細胞を培養すると、自己複製と全ての分化細胞の産出を繰り返し、腸管上皮とよく似た構造体(オルガノイド)が見事にできた(図5)。
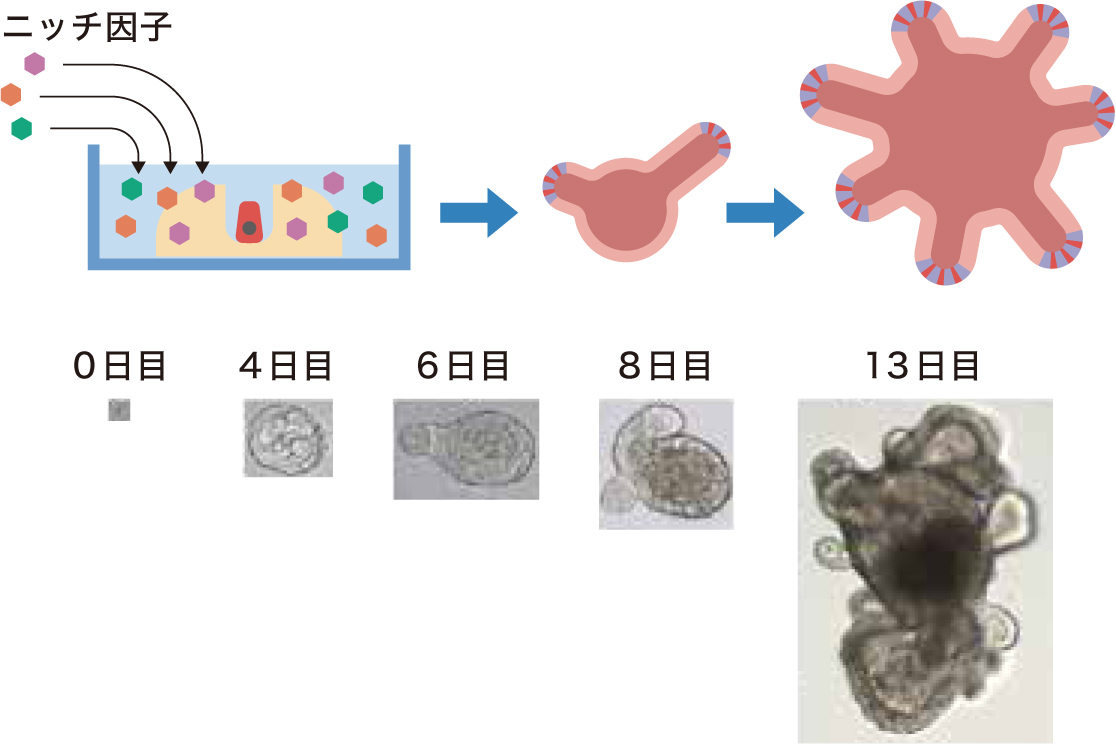
(図5) ニッチ再構築によりできるオルガノイド
培養皿のうえにニッチを再構築し、CBC細胞を培養すると自己複製と分化細胞の産出を繰り返しオルガノイドができる。オルガノイドは全ての分化細胞をもっている。
写真:Sato T , et al. Nature (2009) 459, 262-265より改変
続いて、ニッチ因子を出している細胞を追跡したところ、CBC細胞ととなり合うパネート細胞だった。これで、パネート細胞は、CBC細胞から分化した細胞であるとともに、ニッチ因子を提供し、幹細胞としての機能を維持させる細胞とわかった。さらに、パネート細胞の数は一定であるのに、CBC細胞は毎日2つの幹細胞を生むので、パネート細胞から離れてニッチ因子を受け取れなくなったCBC細胞が分化していくこともわかった(図6)。
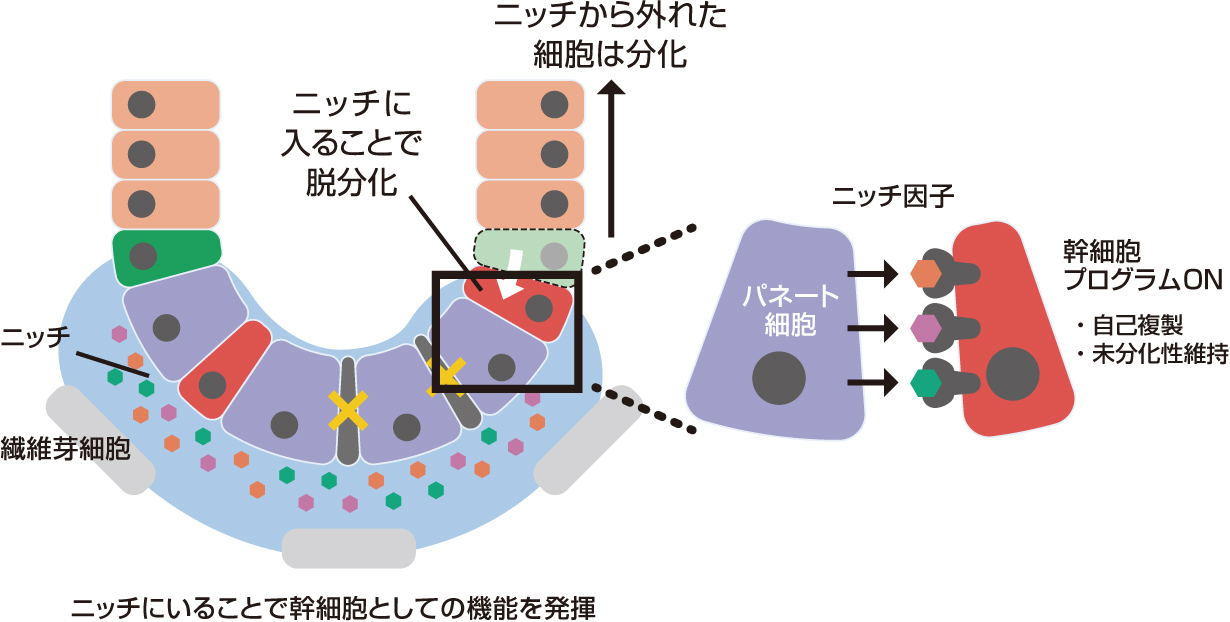
(図6) 見えてきた腸管上皮幹細胞のニッチの実態
体内のさまざまな組織幹細胞にそれぞれのニッチがあると考えられてはいるが、その詳細はこれまでわかっていなかった。私たちの研究は、哺乳類での幹細胞ニッチの実態を明らかにした初めての成果である。最近になって、腸管上皮ではCBC細胞の子孫細胞だけではなく、その周りに存在する線維芽細胞も同様にニッチ因子を出し幹細胞を支えていることもわかってきた。
5.幹細胞とニッチの研究が拓いた新たな展開
ニッチの再構築によってオルガノイドをつくり出す私たちの技術は、世界中で使われている。最初はマウスの小腸の腸管上皮幹細胞で開発した技術だが、マウスやヒトの胃、大腸、肝臓、膵臓、乳腺、前立腺などさまざまな組織幹細胞に応用されるようになってきている。
これまでは、ヒト組織の研究は培養技術の欠如のためほとんど不可能とされ、代わりにマウスなどの実験動物を用いてきた。しかし、オルガノイドの培養技術用いれば、ヒト組織で細胞のはたらきや、病気のときのふるまいを観察できる。さらに、患者さん自身の細胞の培養も可能なのである。私たちは、この技術をがんや再生の研究に用い、一人一人に最適な治療を選択する個別化医療につなげたいと考えている。

佐藤俊朗(さとう としろう)
2003年慶應義塾大学医学部大学院単位取得退学。2004年博士(医学)。同大学COE特別研究員、米国Stowers Institute for Medical Research研究員、オランダHubrecht Institute研究員を経て、2011年より慶應義塾大学医学部消化器内科特任助教。現在、同大学特任准教授。
写真:研究室のメンバーと(筆者:中央)。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)