RESEARCH
ひとつの細胞の中のはたらく核と続く核
テトラヒメナは、繊毛をつかい水中を泳ぐ真核単細胞生物である。独特のしくみで1つの細胞の中に異なる2つの核をつくるが、多細胞生物が多様な細胞をつくりだすしくみとの共通点がある。一風変わった小さな生きものから、生命をつなぐ本質を見つけたい。
泳ぐテトラヒメナ(体長30~50μm)
メチルセルロース溶液中で動きを遅くして撮影
1.ゲノム内の機能不明配列
私たちヒトのゲノムの解析の結果、その95%が機能のわからない配列であることがわかった。ここにはトランスポゾン(註1)と呼ばれるゲノム上を移動できる反復配列などが含まれており、ゲノムはこれらを先祖から受け継ぎ、子孫に伝えているのである。私たちのからだの中で、世代を超えて遺伝情報を伝えることができるのは、生殖細胞と呼ばれる卵と精子だけであり、生殖細胞を運ぶのは、からだをつくり日々の生活を営む一代限りの体細胞である。
真核単細胞生物であるテトラヒメナは、ひとつの細胞の中に2つの異なる核を持つことで、生殖と生きるための役割とを成し遂げている。私はテトラヒメナの2つの核に注目して、その違いを生み出すしくみを解き明かそうとしている。
註1:トランスポゾン
動く遺伝子として発見され、特定の配列をもち、ゲノム中で移動または増幅する配列で、同じ配列が多数コピー存在する反復配列である。機能は不明で生きるのに不要なガラクタ配列とも呼ばれるが、現在研究が進められている。
2.テトラヒメナの2つの異なる核
テトラヒメナはゾウリムシの仲間の繊毛虫類に属する単細胞生物で、細胞の表面を覆う無数の繊毛を使って池の中を動き回る。私たちが実験に用いるテトラヒメナはアメリカのマサチューセッツ州、ウッズホールの池で1950年代に採取された個体に由来し、現在も世界中の研究者に使われている株である。テトラヒメナの2つの核は大きさが異なり、それぞれ大核と小核と呼ばれる(図1)。小核は、生殖系列の核として有性生殖の際にいわゆる減数分裂による遺伝子の組換えと次世代の大核の形成を担う。5本の染色体が維持する2倍体ゲノムに全ての遺伝情報をもち、転写が抑制されている。大核は、体細胞核(栄養核と呼ばれることもある)として生きるために必要な遺伝子を発現している。新たに形成されるときには小核のゲノムのもつ機能不明配列に当たる3分の1の領域が取り除かれ、残りを約45倍に増幅し多倍体となる。有性生殖の際には壊され、次世代の大核にその座を譲る。このようにテトラヒメナの小核と大核の特徴は、多細胞生物における生殖細胞と体細胞の違いに類似している。
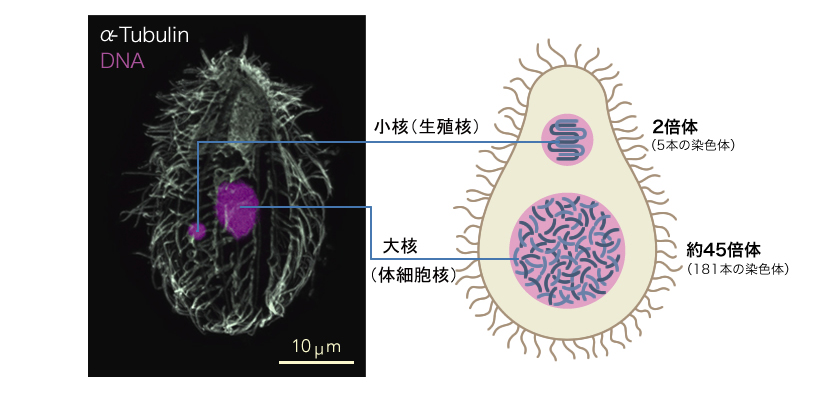
図1: テトラヒメナ(Tetrahymena thermophila)の2つの核
写真(左)は共焦点顕微鏡で見たテトラヒメナの核(赤:DNA、白:抗チューブリン抗体染色)。小核は生殖核としてのゲノムをもち、大核は体細胞としてのゲノムをもつ。
3.親のゲノムを真似して機能不明配列を除く
栄養がある環境では、テトラヒメナは無性的に増殖し(図2上)、大核と小核のゲノムはコピーされ娘細胞の大核と小核に受け継がれる。一方、栄養飢餓状態になると、接合型(ヒトの性別に相当する。ヒトは基本的に男女の2種類しかないが、テトラヒメナは7種類もある)の異なる2つの細胞が融合し有性生殖(接合)で子孫をつくる(図2下)。有性生殖においては、 2倍体の小核のみが減数分裂して半数体ゲノムをもつ核となり、パートナー間で互いの核を交換する。その後、異なる細胞由来の半数体核が融合し2倍体ゲノムを持つ融合核となり、次世代の小核と大核に分化する。新たな大核が分化する過程では、小核のゲノムから機能不明配列を含む約12,000箇所、全体の約1/3を占める領域(Internal Eliminated Sequence、IES)が取り除かれる。ゲノム中のIESの見分け方については、過去15年ほどの研究から、約30塩基の短い小分子RNAを用いて自身のゲノム上のトランスポゾンを見つけ出していることがわかってきている(図3)。
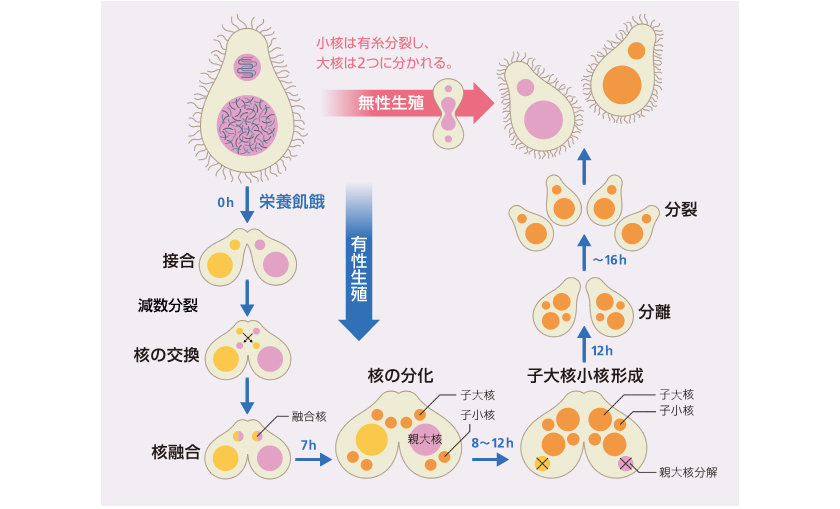
図2: テトラヒメナの生活環
通常は無性生殖し、栄養飢餓状態になると有性生殖をする。有性生殖では、小核が減数分裂し、性の異なる他個体と核を交換後、融合により子世代の核をつくる。
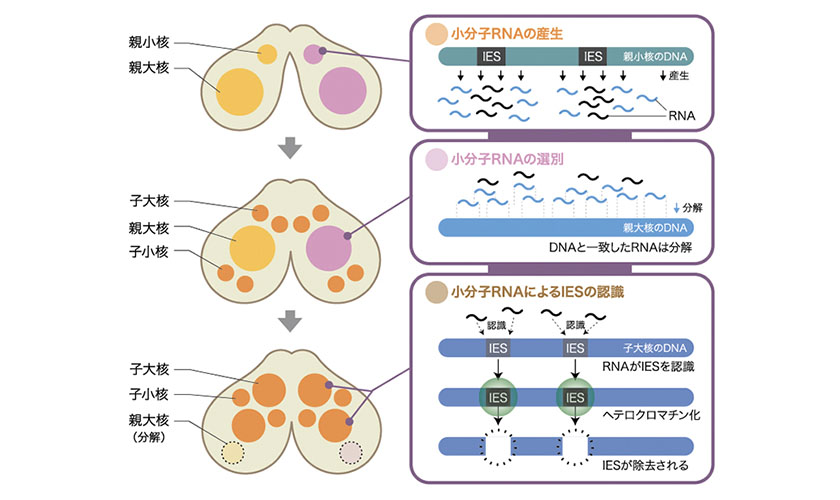
図3: 小分子RNAによって誘導されるIESの標識と除去
有性生殖の初期に小核のゲノムが転写され、小分子RNAがつくられる。小分子RNAはもともとある親大核に移動し、ここで大核に存在する配列を持つRNAが分解される。その結果、残った小分子RNAは、IESに相補的な配列を持つことになる。次にこの小分子RNAは次世代の大核(子大核)へ移動する。ここで、この小分子RNAが子大核ゲノムに含まれるIESの配列を見つけ出し、IESのDNAを巻いているヒストン(註2)に目印をつける。この目印を認識するPdd1pと呼ばれるタンパク質が結合して、IESはヘテロクロマチン化(註3)する。ここで用いられる目印とその認識タンパク質は、多細胞生物がエピジェネティックに遺伝子の働きを抑制する際に用いるヘテロクロマチン形成に使われるものと同じである。テトラヒメナでは、ヘテロクロマチンが最終的にIESを取り除く際の標的になるのである。
註2:ヒストン
真核生物のゲノムDNAと結合してクロマチンをつくるタンパク質。メチル化などの修飾をうけるとそのメチル化修飾を認識するタンパク質が結合し、クロマチンの凝集状態が変化する。
註3:ヘテロクロマチン
クロマチンが凝縮し、転写などがおこらない不活性な状態。多細胞生物では、分化した細胞で使わない遺伝子やトランスポゾンなどの不要な配列がヘテロクロマチン化されていることが多い。
4.集めてから取り除く
ヘテロクロマチン化されたIES領域の様子を顕微鏡で観察すると、初めは、核の中でランダムに存在していた。しかし、有性生殖の進行とともにその領域は核内の数個の構造体に集まっていく様子が観察される(図4A)。これは、多くの動植物のヘテロクロマチンでも見られる現象である。そこで私たちは、この凝集のしくみを明らかにしようとヘテロクロマチン凝集体に存在するタンパク質の探索に乗り出した。
有性生殖期だけに存在するタンパク質をリストアップし、それらがヘテロクロマチン凝集体に存在するかどうかをGFPと呼ばれる蛍光タンパク質でラベルし可視化した。93タンパク質の局在を観察した結果、8つの新たなタンパク質を見出した。この中のひとつをJub1pと命名した。次に、この遺伝子を壊した細胞を作ったところ、ヘテロクロマチン自体は正常に形成されるが凝縮はしなかった(図4B)。これでJub1pがヘテロクロマチンの凝集に必要なタンパク質であるとわかった。また、ヘテロクロマチンができてもそれらが凝集しないとIESの除去が起こらないことから、凝集が引き金になってゲノムからのIESの除去が誘導されることが示唆された。捨て去るゲノム領域の凝集は、残す配列と壊す配列の分離に重要な役割をしていると考えられる。ゲノムの1万箇所以上を切り取るというミスが許されない反応の制御には、幾重もの制御機構が働いているようである。
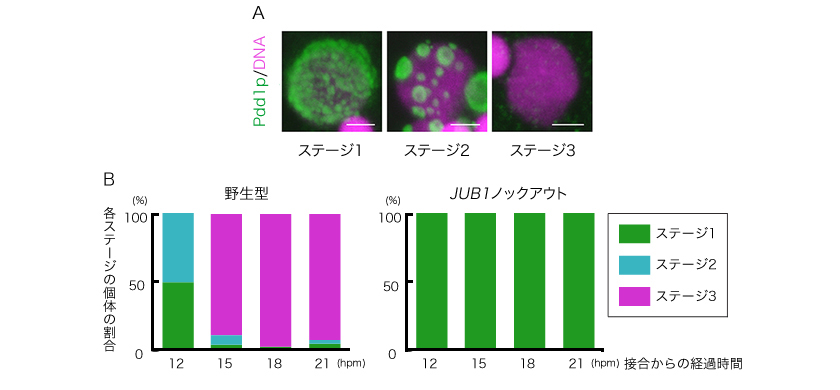
図4: ヘテロクロマチンの凝集の様子としくみの検証
A・ヘテロクロマチンの凝集:
IES(約12,000か所)がPdd1p(緑)によってヘテロクロマチン化し、凝集が引き金となって除去され、大核が完成する(赤:DNA)。ステージ1(接合から〜12時間)ではヘテロクトマチンは分散している。ステージ2(〜14時間)にはヘテロクロマチンが集まり凝集している。ステージ3(〜16時間)は、ヘテロクロマチン(IES)が取り除かれた後である。
B・Jub1pはヘテロクロマチン凝集に必要:
無操作の集団(野生型)と遺伝子操作によりJub1pタンパク質をつくらない集団(JUB1ノックアウト)の接合後の時間における各ステージ(A)の個体の割合。野生型では時間とともに凝集が進むが、JUB1ノックアウトでは凝集がおこらない(ステージ1のまま)。
5.リン酸が電荷を変える
では、Jub1pはヘテロクロマチン化されたIES領域の凝集にどのように関与しているのであろうか?ここで注目したのが、メチル化したヒストンを認識し、ヘテロクロマチン形成に関わるPdd1pタンパク質である。これまでに、Pdd1pはヘテロクロマチンが形成される際にリン酸化され、その後ヘテロクロマチン凝集の際に、脱リン酸化することが知られていた(図5上)。そこでJub1pの遺伝子、JUB1を破壊した細胞でPdd1pのリン酸化状態を観察すると、リン酸化は受けるが、脱リン酸化は起きないことがわかった(図5下)。次に、脱リン酸化と凝集の関係を確認するために、脱リン酸化酵素を阻害する薬剤を与えた個体でヘテロクロマチンを観察したところ、ヘテロクロマチンの凝集とDNAの削減が阻害された。つまりJub1pがPdd1pの脱リン酸化に関与し、それがヘテロクロマチンの凝集とそれに続くDNA削減に必要だと考えられる。リン酸化はタンパク質に負電荷を与える修飾なので、負電荷の減少が凝集に引き起こすのではないかと予想した。ここでは、リン酸化を模倣したタンパク質をつくり、それに正電荷を加えて電荷を中和したところ、ヘテロクロマチンの凝集とDNAの削減能が回復した。こうして、ヘテロクロマチン化された領域の凝集は、Pdd1pの電荷によってコントロールされていることが明らかになった。
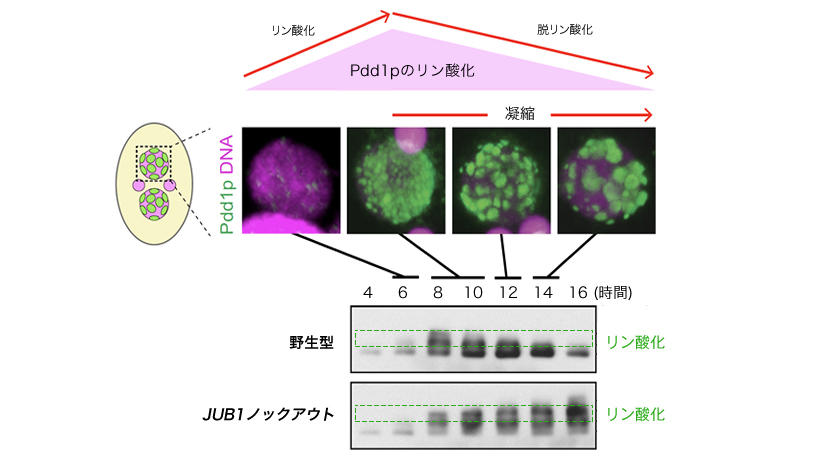
図5: Pdd1p のリン酸化の増減とヘテロクロマチンの凝集
上・Pdd1pタンパク質のリン酸化の増減:
Pdd1pのリン酸化修飾は、ヘテロクマチン形成が進むときにピークを迎え、その後凝集が始まるとリン酸化が減少する(脱リン酸化)。
下・Jub1pはPdd1pの脱リン酸化に必要:
ヘテロクロマチン凝集の経過と野生型とJUB1ノックアウトのPdd1pタンパク質のリン酸化状態の関係。野生型では脱リン酸化が進み、凝集がおこる。JUB1ノックアウトではリン酸化は変わらず、凝集は起きない。つまりヘテロクロマチン凝集に先立ち、Jub1pを介してPdd1pの脱リン酸化がおこる。
6.RNAの接着剤
電荷の変化によって、ヘテロクロマチンの凝集を促進するのは何であろうか?次に私たちは、ヘテロクロマチンをつなぐ分子としてRNAに注目した。IESからはRNAが転写されており、RNAは負電荷をもつためである。試験管内でPdd1pとRNAを混ぜて、Pdd1pのRNA結合能を調べると脱リン酸化状態ではPdd1pはRNAと結合することが明らかになった。そこで、一度リン酸化されたPdd1pが脱リン酸化されることによって、RNAと結合し、RNAが糊のようはたらいて複数のヘテロクロマチン化された領域が集合するというモデルを立てた(図6)。生体内での真偽を確かめることは今後の課題であるが、このモデルを支持するように、ヘテロクロマチンの凝集に必要なタンパク質として、RNA結合能を持つタンパク質を見出している。
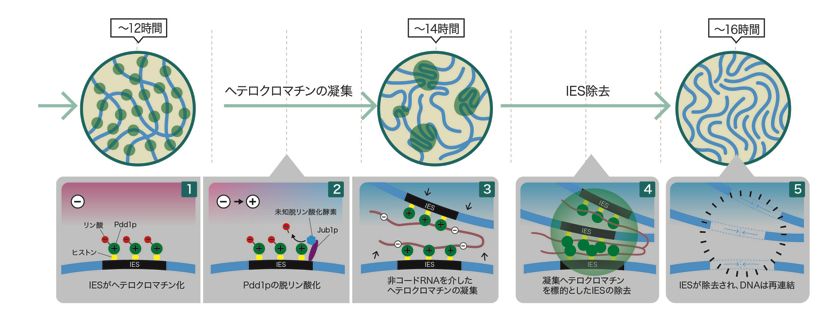
図6: ヘテロクロマチンの凝集とIES除去のモデル
①IES配列のメチル化ヒストン(黄色)にリン酸化(赤:マイナス(—)に帯電)Pdd1pが結合し、ヘテロクロマチン化がおこる。
②Jub1p(紫)が未知の脱リン酸化酵素(青)を誘導し、Pdd1pが脱リン酸化される。
③脱リン酸化によりプラス(+)に傾き、マイナス(-)電荷をもつ非コードRNAが引き寄せられる。
④RNAによりヘテロクロマチンが引き寄せられ凝集がおこる。
⑤凝集したヘテロクロマチンが取り除かれ、DNAが再結合する。
7.機能不明配列がつなぐ2つの核
テトラヒメナでは、体細胞である大核のゲノムは、トランスポゾンなどの機能不明配列を取り除き、活発に転写している。一方で、大核で除かれた配列は、生殖核にあたる小核には維持されており、次世代に伝えるが転写は抑えられている。多細胞生物の発生では、受精卵のゲノムは遺伝子のオンオフを担うヒストン修飾や発現を抑制するヘテロクロマチン化などのエピジェネティックな印づけによって様々な体細胞へと分化する。単細胞で生きるテトラヒメナは、ヘテロクロマチン化によって使わない配列を抑制どころか除いてしまうという独自の方法で体細胞核を生み出す。また、機能不明配列は小核の染色体を安定に保つのに関わるとも言われる。そこで、そこにあるトランスポゾンが、実は2つの核で伝える役割とはたらく役割を分担する鍵として働いているのではないかと考えている。あらゆる生きもののゲノムがもつ機能が説明されていない領域に生命の堅固性を支える重要な機能が見つかるかもしれない。そのときを思いながら小さな単細胞生物テトラヒメナと向き合っている。

片岡研介(かたおか・けんすけ)
2007年兵庫県立大学大学院生命理学研究科修了。博士(理学)。同年よりオーストリアInstitute of Molecular Biotechnology of the Austrian Academy of Sciences博士研究員。2016年12月より基礎生物学研究所助教。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)