RESEARCH
細菌社会の情報運び役
メンブレンベシクル
単細胞生物である細菌は、互いに我関せずで生きていると長年思われていたが、細胞間で情報伝達を行い、遺伝子発現を調節し合うことで、集団としてはたらいていることがわかってきた。私たちが思う以上に細菌は社会的であり、その個と集団の関係は多細胞生物を想起させるほどである。
1.分化した細菌の集合体
掃除をさぼった排水溝がヌルヌルしたり、朝起きて歯の表面がザラザラするのを感じたりするのは、バイオフィルムと呼ばれる細菌の集合体による。細菌が出す物質がスライム状の細胞外マトリクスを形成し、細菌はその中で暮らしているのだ。細胞外マトリクスは水分の他、主にタンパク質や脂質、多糖類、DNAから成り、細胞同士を接着させるはたらきをもつ。納豆のネバネバも納豆菌がつくる細胞外マトリクスである。バイオフィルムは、細菌が増殖する足場となる他、抗生物質などの薬剤の効果を妨げたり、乾燥や捕食から身を守るなど、細菌の強靭さのもととなっている。
集団を形成した細菌は、単細胞で浮遊している状態とは異なり、各個体が異なる役割を担うようになる(図1)。集団内の遺伝子発現も個体によって差があることが知られている。細菌集団は均質でなく、機能的に分化した社会性をもつのだ。集団の構造は、細菌が出すシグナル分子や酸素濃度、栄養状態などの環境変化に応じて柔軟に変わる。では、細菌はどのように互いに情報を伝達し、遺伝子発現を調節し合って、環境に応じた集団を形成しているのだろうか。
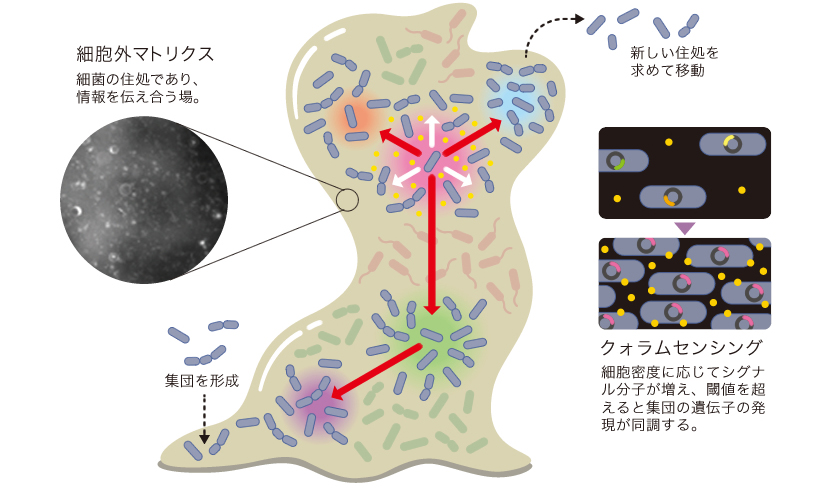
図1:細菌の集合体(バイオフィルム)
情報伝達により遺伝子発現を調節し合い、各個体は集団の一部としてふるまう。
2.細菌間の情報伝達を担うシグナル分子
細菌は情報を伝え合うために、低分子化合物のシグナル分子を用いるが、よく知られているのがアシル化ホモセリンラクトン(AHL)類である。AHLには炭素数4〜18の側鎖をもつ様々な種類があり、側鎖の長さと化学修飾(註1)によって多様性が生じている。通常、細菌種によって異なるAHLとそれを特異的に受け取る受容体とがセットで存在するので、AHLは主に仲間内でやりとりされると考えられている。
AHLを介した情報伝達では、細菌の増殖や集合が進むにつれAHL濃度が増し、これが閾値に達すると集団内の遺伝子発現が同調する。クォラムセンシング(QS) と呼ばれるこのしくみでは、AHLの素早い拡散が鍵となる。しかし、拡散性が高いAHLは側鎖が短いものに限られ、長鎖AHLは細胞膜に留まりやすいうえに水に溶解しないため伝達されにくい。このようなAHLの環境中への放出や、周囲の細菌への伝達については解明されていなかった。そこで私たちは、長鎖AHLが細胞膜に蓄積することに着目し、細菌が放出する細胞膜によって構成される数十から数百nmの微小粒子メンブレンベシクル(MV)を調べることにした。
3.メンブレンベシクルに“言葉”を託して
MVは細胞外への放出後、周囲の細菌や宿主細胞に付着・融合し、様々な物質の輸送に関わることが知られている(図2)。ほとんどの細菌がMVを形成し、環境中の物質循環や生態系に大きな影響を及ぼすと考えられてきた。MVは水中で分散するので、私たちはこれが長鎖AHLのような疎水性分子の運搬に利用されているのではないかと考え、側鎖の炭素数が16の長鎖AHL (C16-HSL)を産生するParacoccus denitrificans(P. denitrificans)を用いて実験を行った。
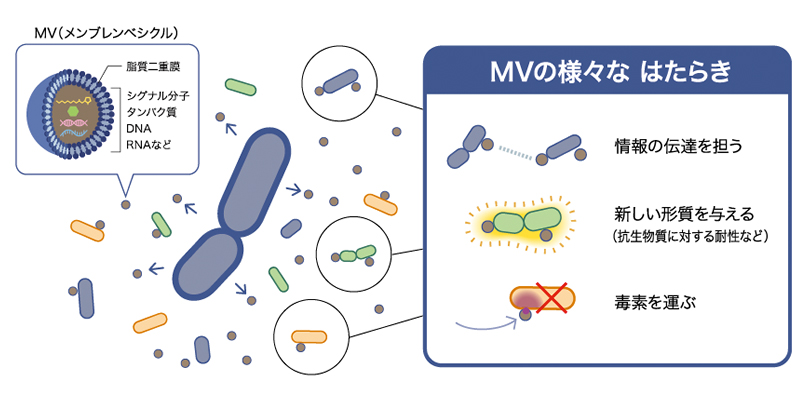
図2:メンブレンベシクル(MV)の機能
MVの機能は多岐に渡る。情報の伝達を担うだけでなく、周囲の細菌に新たな形質を与える他、毒素を運ぶこともある。また、MVと細胞の表層は似ているため、細胞表層をターゲットにした薬剤やウイルスのおとりとしてはたらき、細菌の生存を助けるという面をもつ。
C16-HSLは、P. denitrificansの凝集を阻害することがわかっている。そこで、C16-HSLを産生できない変異株では凝集の阻害がないことを確認した後、そこにC16-HSLまたは野生型MVを加えたところ凝集が阻害された(図3)。これは、MVによってC16-HSLが細胞間を伝わっていくことを示している。また、変異株に加えるC16-HSLの濃度を変え、細菌の凝集阻害には1細胞あたり3〜350分子のC16-HSLが必要であることがわかった。一方野生型のMVには、1粒につき10万分子ほどのC16-HSLが含まれている。MVには、QSの閾値をはるかに超えるシグナル分子が含まれており、細胞がMVを1つ受け取れば遺伝子発現が調節されると考えられる。また、P. denitrificansのMVはP. denitrificansに付着しやすいことがわかった。

図3:メンブレンベシクルによる細胞間情報伝達を調べた結果
C16-HSL はP. denitrificansの細胞凝集を妨げる。C16-HSLを生産できない変異株では凝集(赤線囲み)が起こるが、C16-HSLまたは野生型MVを加えると、野生型と同様に凝集は起こらなかった。
短鎖AHLは分子がそのまま単純拡散で伝わるので、周囲の細菌全てに届く反面、距離が長くなるにつれて希釈され閾値を下回る。一方MVを介した場合、1粒届きさえすれば遠く離れた同種の細菌にも選択的に情報を伝えられる(図4)。海洋や河川などの広大な水環境では、MVが有効にはたらいているのではないだろうか。
細菌の情報伝達を私たちの“言葉”に例えるなら、短鎖AHLは“声”、長鎖AHLはMVという“手紙”に記されたメッセージと言えるかもしれない。
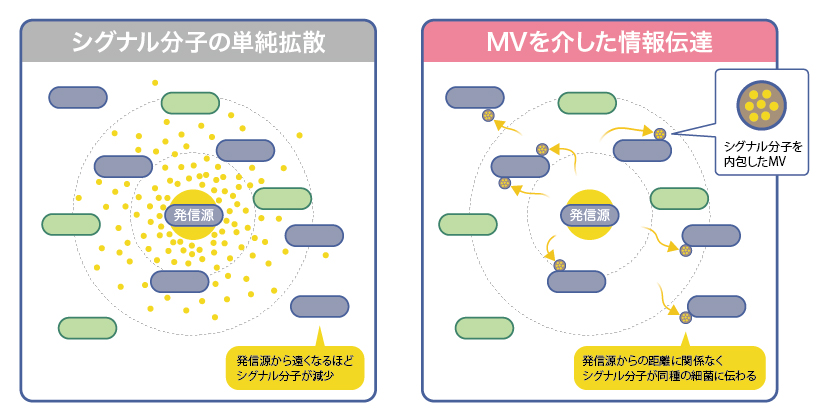
図4:シグナル分子の異なる伝達方法
シグナル分子の単純拡散の場合、距離が長くなるほど希釈され届かなくなるが、シグナル分子がMVに濃縮されることで、距離に関わりなく高濃度のシグナルが届けられる。
4.細胞死を伴う2つのMV形成機構
細菌集団内の情報伝達で、MVが重要な機能をもつことがわかったが、その形成過程は長年謎に包まれていた。細菌には、グラム陰性細菌とグラム陽性細菌の2種類があり、前者は細胞膜がむき出しになっているのに対し、後者は厚い細胞壁で覆われている(図5)。そこで両者におけるMVの形成過程を調べた。

図5:グラム陰性細菌(左)とグラム陽性細菌(右)の表層構造
これまでグラム陰性細菌では、外膜がたわむことでMVが出芽し、その後も細胞は生き続けると考えられていたが、証明はなされていなかった。私たちは、グラム陰性細菌の一種、緑膿菌を超解像顕微鏡(註2)で観察した結果、集団中の一部の細胞が破裂し、破裂した細胞膜の断片がMVを再構成するという、全く新しいしくみをとらえることができた(図6)。この細胞破裂の引き金は、内在性ファージ(細菌に感染するウィルス)に由来する酵素のエンドリシンであり、細胞表層のペプチドグリカン層(細胞壁)を分解する活性があることも見出した。通説とは異なり、MV形成には細胞死を伴うこともわかった。
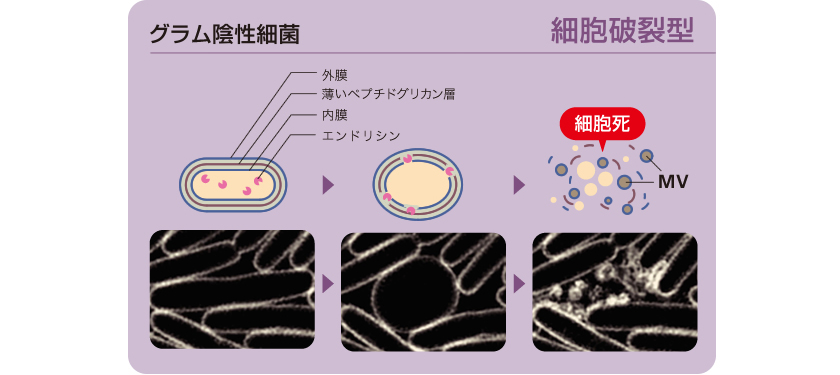
図6:グラム陰性細菌である緑膿菌のMV形成過程をとらえた動画
薄いペプチドグリカン層が壊され、細胞が破裂した後MVを再構成する。
エンドリシンはファージ由来であるため、多くの細菌ゲノムに保存されている。そこで私たちは、グラム陽性細菌でもMVの形成にエンドリシンが関わるのではないかと考えた。グラム陽性細菌の一種、枯草菌がMVを放出する過程を、共焦点顕微鏡(註3)およびクライオ電子線トモグラフィ(註4)で撮影したところ、グラム陰性細菌の細胞破裂とは異なるしくみをとらえることに成功した。枯草菌では、エンドリシンの作用で細胞壁に穴が開くが、細胞壁が厚いために破裂は起こらず、その穴からシャボン玉が飛ぶようにMVが形成されたのである(図7)。このMV形成は集団の一部の細胞で誘導され、緑膿菌と同じくその細胞は死を迎えることもわかった。
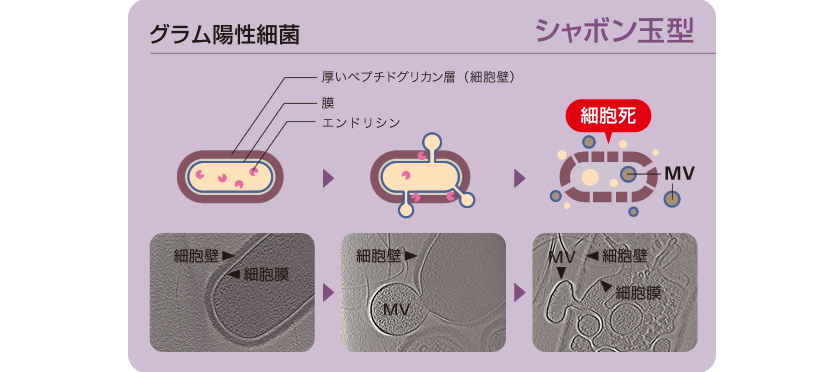
図7:グラム陽性細菌である枯草菌のMV形成過程をとらえた動画
瞬間凍結したサンプルを様々な角度で撮影し、画像を重ね合わせて3次元イメージを構築。 厚いペプチドグリカン層に穴が開き、そこから膜がシャボン玉のように出芽してMVを放出する。
5.生きものの社会性はどこから来るのか?
エンドリシンによるMV形成は細胞死を伴うが、その結果残されるMVやDNAなどの細胞外マトリクスは細菌集団内で利用されている。エンドリシンをもたない株では、正常なバイオフィルムの形成は見られない。また、エンドリシンはDNA損傷や外部刺激によって誘導されることがわかっている。ここで起きている細胞死が、社会性をもつ集団で暮らす細菌の利他的行動なのか、排他的行動の結果なのか、生物の社会性の起源を考える上でも興味深い研究テーマと考えている。
.jpg)
豊福 雅典(とよふく・まさのり)
2008年日本学術振興会特別研究員、2009年筑波大学大学院生命環境科学研究科生物機能科学専攻博士後期課程修了。博士(農学)。2010年上原記念生命科学財団海外ポストドクトラルフェロー(チューリッヒ大学)、2011年筑波大学生命環境科学研究科研究員を経て、2012年より同大学生命環境系助教。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)














