RESEARCH
生涯はたらくニューロンを支える
脳の免疫担当細胞
脳のニューロンは長生きである。加齢とともに突起が縮み、シナプスは減るが、大部分は一生の間はたらき続ける。この活躍を支える細胞のひとつ、ミクログリアは脳の細胞の中で特殊な存在だ。
1.脳が老いるとはどういうことか
脳は大きく分けてニューロン(神経細胞)とグリアと呼ばれる細胞から成る。情報を伝えるニューロンは感覚や運動、呼吸や体温維持、情動や記憶、認知や人格などを司る主体だ。一方、ニューロンのはたらきを助けるグリアは、脳内の環境を整えたり、栄養を供給したりしており、アストロサイト、オリゴデンドロサイト、ミクログリアの3種類がある。
ニューロンには外部から情報を受け取る樹状突起と、別のニューロンに情報を伝える軸索がある。ひとつのニューロンは平均一万個のシナプスで別のニューロンと接合し回路を築いている。皮膚や血液の細胞は新陳代謝によって日々新しい細胞に置き替わるが、ニューロンは基本的に同じ細胞がほぼ一生はたらき続ける。そこで、長い年月が経つと、ニューロンはその特徴的な形態を保てなくなり、複雑に枝分かれしていた突起が減少したり縮んだりする。こうしてシナプスが減少し、他のニューロンとの情報伝達がうまくできなくなったのが老化脳なのである。
2.脳を守る細胞ミクログリア
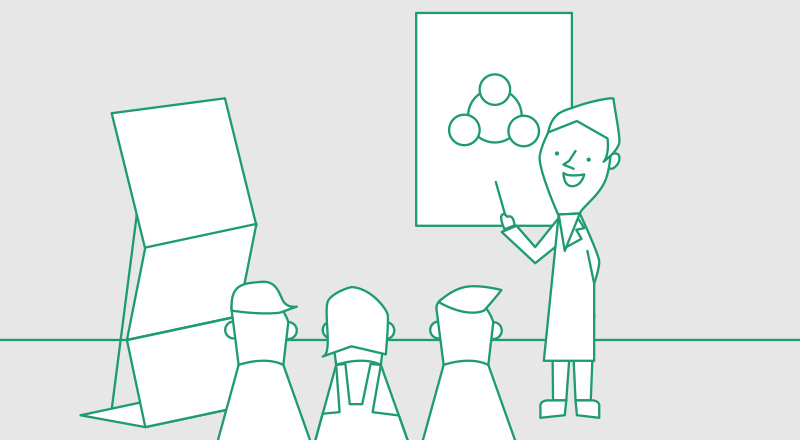
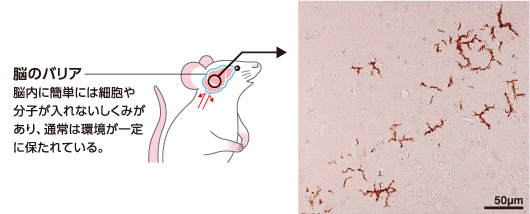
ミクログリアは脳の細胞の中で極めてユニークな特徴をもつ存在だ。ニューロンや他のグリアが神経外胚葉に由来するのに対し、ミクログリアだけが免疫細胞の一種(註1)に由来するのである。胎生期に脳に入り、その後、骨髄からの新たな供給はほとんどない。ミクログリアは、枝分れの多い突起を放射状に伸ばして動かしながら、脳内の異常を探知している(図1)。ひとつのミクログリアが探知する脳領域(テリトリー)は決まっており、互いに重なりあうことなく脳全体に分布し、領域内に異常を見つけると、通常は突起を伸ばして修復するが、障害が大きいとその場に移動してはたらく。病原体を見つけると排除し、死んだ脳細胞があれば貪食する。その形態は変幻自在で、活性化すると突起が太く短く縮み、細胞を貪食するときは丸く突起のない形になる。ニューロンや他のグリアが特定の場所で一定の形態を保ちながら機能するのとは対照的に、ミクログリアは自身が変化しながら脳内環境を整えニューロンを保護している。
(図1) ミクログリアのはたらきと形
通常、ミクログリアは突起を広げてニューロンに触れ脳内を監視しているが、急性の傷害を脳が受けると 突起を太くしニューロンとの接触を増やす。ミクログリアのはたらきには、突起が大きな役割をはたしている。
(註1) 免疫細胞の一種
ミクログリアの起源について長く論争が続いていたが、卵黄嚢の原始マクロファージに由来することが2010年に報告された。
3.ミクログリアの形の変化を追う
ニューロンは、加齢に伴って形態も、機能もともに衰えるが、その原因は明らかではない。実は、ヒトの老化脳ではミクログリアの多くに形態異常が見られること、アルツハイマー病ではニューロンが衰えるより先にミクログリアの形態異常が現れることが知られている。そこで私たちは、加齢にともなってミクログリアのニューロンを保護するはたらきが低下して、ニューロンが変形するのではないかと考え、マウスを用いてミクログリアの形態変化を探った。
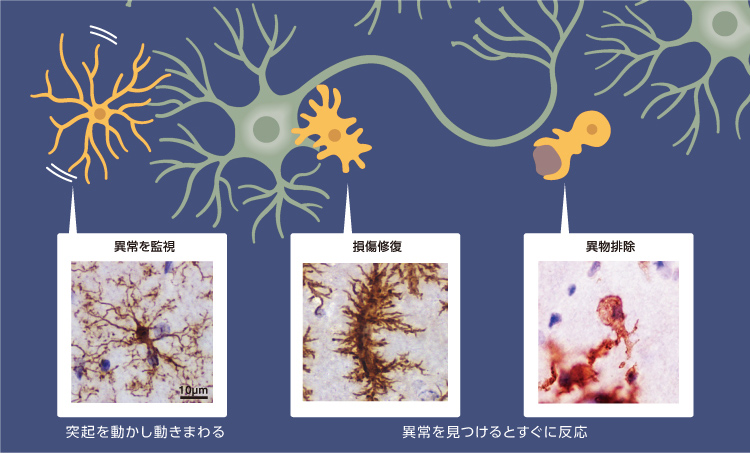
マウスの寿命は2〜3年と短いため、通常はヒトのようなニューロンの変形が見られない。そこで、脳の老化が通常より早く進む老化促進モデルマウス(註2)SAMP10系統を用いた。SAMP10マウスは平均寿命が14ヶ月程と短く、しかも7ヶ月齢頃からニューロンの樹状突起の退縮、シナプスの減少と脳の萎縮が見られる系統で、ヒトの老化脳研究のモデルとされている(図2)。
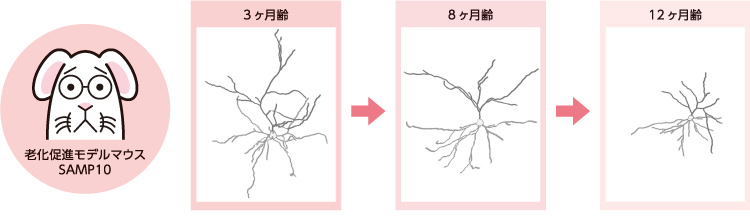
(図2) 老化促進モデルマウスのニューロンの加齢変化
SAMP10マウスは7ヶ月齢頃からニューロンが変形し、シナプスが減少する。 加齢にともない学習能力は衰える。
まず、通常のマウス(SAMR1系統)とSAMP10マウスのミクログリアの形態変化を比較した。SAMR1マウスでは若齢期(3ヶ月、8ヶ月齢)には突起の枝分かれが多く、突起の長さの総計も大きいが、14、24ヶ月齢になるとそれがともに減少することがわかった。細胞体の面積や、細胞体から出る突起の数は変わらず、病的な形態異常はほとんど見られなかった。これがマウスでのミクログリアの正常な老化の過程と言える(図3)。
一方、SAMP10マウスのミクログリアは、3ヶ月齢ですでに突起の枝分かれが少なく、突起の長さの総計も小さい。細胞体の面積、細胞体から出る突起の数、テリトリーの面積はSAMR1マウスと変わらないが、球状に膨れ連なった突起や断片化した突起など病的な形態異常の割合が高くなっていた。すなわち、SAMP10マウスのミクログリアは、若齢期から正常な突起が壊れて著しく少なくなっており、領域内の異常探知能力が低くなっていると考えられる。
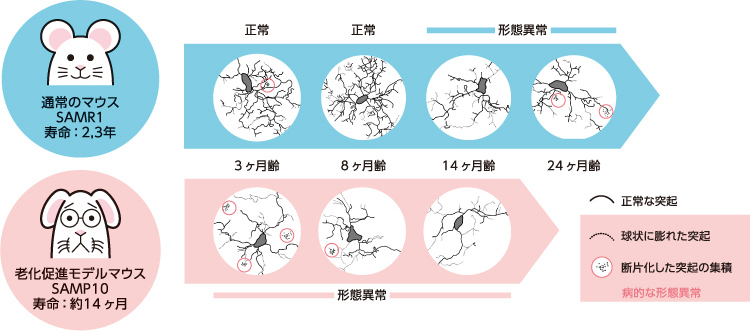
(図3) ミクログリアの加齢変化の比較
脳の組織切片を作製後、ミクログリア特異的に発現するタンパク質Iba-1の抗体で染色し形態を描画した。通常のマウスでは14ヶ月齢以降にしかあらわれない加齢変化が、SAMP10マウスでは3 ヶ月齢から見られた。さらに病的な形態異常の割合も高かった。
(註2) 老化促進モデルマウス(SAM : Senescence Accelerated Mouse)
日本で開発された近交系マウスで、老化が早く進むSAMP系統群と正常な老化を示すSAMR系統群からなる。SAMP系統群は学習・記憶障害や骨粗鬆症、白内障など系統ごとに特異的な老化関連病態を発症する。
4.細胞同士の関わり合いで成り立つ脳の修復機構
ミクログリアの形態異常が、脳の機能にどう影響するかを具体的に調べた。ミクログリアにはニューロンの損傷を修復する機能があることが知られている。例えば、毒物であるカイニン酸を投与して海馬のニューロンが損傷すると、投与直後からミクログリアやアストロサイトが反応を始め、3日目に最も活発にはたらくことが知られている。そこで、3ヶ月齢のSAMR1とSAMP10マウスにカイニン酸を投与し、3日目の海馬で発現が増加する遺伝子を調べた。その結果、SAMR1マウスではインターフェロンガンマ(IFN-g)、オステオポンチン(OPN)といった、免疫系で情報伝達を担う物質(サイトカイン)やその受容体遺伝子などが著しく増加した(図4)。一方、SAMP10マウスではそのような顕著な増加は見られなかった。
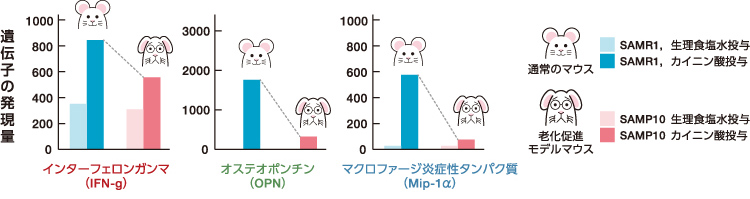
(図4) 海馬損傷後の遺伝子発現量の比較
カイニン酸を投与し3日目の海馬での遺伝子の発現量をマイクロアレイで網羅的に調べた後、リアルタイムPCRを用いて確認した。 比較のために生理食塩水を投与した場合でも計測した。
続いてSAMR1マウスの脳でサイトカインや受容体遺伝子の発現細胞を同定したところ、ミクログリアを中心とした細胞間ネットワークにより、損傷した海馬を修復する様子が見えてきた(図5)。まず、海馬のニューロン損傷に反応してミクログリアがIFN-gを放出し、アストロサイトがそれを受容する。活性化したアストロサイトがミクログリアを呼ぶ分子を分泌し、それに引き寄せられたミクログリアがOPNを放出して、ニューロンやアストロサイトがそれを受容しているようなのである。OPNはニューロンを保護する役割をもつ分子として知られている。
このような細胞間ネットワークが構築されなかった場合どうなるか。私たちはカイニン酸投与30日後の海馬の形態を、SAMR1とSAMP10マウスで比較した。SAMR1マウスの海馬は生理食塩水を投与した対照群との違いが見られなかったのに対して、SAMP10マウスでは海馬が萎縮していた。ミクログリアを中心とした細胞間ネットワークが正常にはたらかず、損傷が修復されなかったのだろう。
ニューロンは脳内で絶えず小さな損傷を受けており、日々、損傷を修復することで恒常性が保たれている。SAMP10マウスでは、若齢期からミクログリアのニューロン保護機能に異常があるため、修復されない損傷が蓄積される。これが、SAMP10マウスで脳が早く老いる原因の一つだと私たちは考えている。こうして、脳の老化のしくみを探るうえで、ニューロンの加齢変化に加えてニューロン以外の脳の細胞の活動や脳内環境の変化を知ることが重要であることがわかってきた。
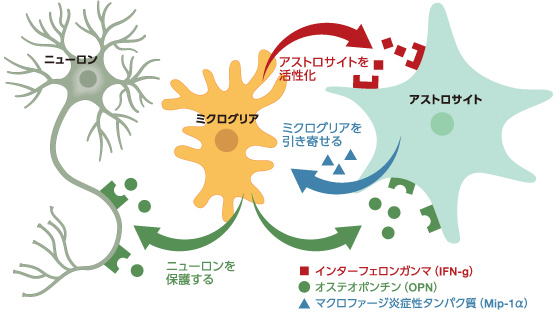
(図5) 海馬を修復する細胞間ネットワーク
脳が損傷をうけた場合、ミクログリアはアストロサイトなど他の細胞とも相互作用しニューロンを保護しているようだ。アストロサイトはニューロンに栄養を供給するグリア細胞として知られている。
5.脳と免疫系の関わり-新たに見つかった骨髄由来の脳の細胞
かつて脳は免疫系から隔絶された特別な器官であると考えられていたが、決してそうではない。実際に、感染で全身に炎症が起きれば、免疫系組織だけでなく脳内でも炎症性サイトカインが増加し、脳機能を低下させる。風邪をひいて高熱にうなされると集中力がなくなる経験は誰にでもあるだろう。では、全身の免疫系の細胞は脳細胞とどこで、どのように関わり合っているのだろう。
成体では免疫系細胞は全て骨髄に由来する。緑色蛍光タンパク質(GFP)を全身で発現する遺伝子改変マウスの骨髄を通常マウスに移植し、発光を手がかりにドナー由来骨髄細胞(GFP陽性細胞)の移動を追跡する方法がある。私たちはこれを利用して、骨髄由来細胞の頭部での分布を見た。その結果、移植後早期から多数のGFP陽性細胞が脳を取り巻く髄膜、髄膜から派生して脳室内に陥入した脈絡叢、脳内の血管を取り囲む狭い空間に分布していた。脳と外部とを隔てるバリアの部分である。一方、脳内にはGFP陽性細胞はほとんど見られなかった。しかし、60匹ほどの移植マウスを観察するうち、扁桃体など脳の特定の部位にいつも少数のGFP陽性細胞が存在することに気がついた(図6)。しかもその細胞は形態も分子の発現もミクログリアとよく似ていた。未知の免疫系細胞が骨髄から脳の特定の領域にだけ、少しずつ供給されていることを発見したのである。
(図6) 新たに見つかった骨髄由来の脳の細胞
茶色い部分は、ミクログリアとよく似ているが詳細は不明の骨髄由来細胞。特定の領域にだけ常に少量ずつ供給されていることから、脳の免疫系細胞として機能をもっているのではないかと予想している。
6.からだ全体の変化に影響をうけながら進む脳の老い
次の問いは、骨髄由来細胞の脳への進入は加齢によって変化するかということである。私たちはGFPマウスの骨髄を、通常とSAMP10の若齢と老齢マウスに移植し、4ヶ月後に骨髄由来細胞の脳内分布を比較した。その結果、老齢SAMP10マウスの脳でより多くの骨髄由来細胞が、より深部にまで分布していることがわかった(図7)。しかも、老齢SAMP10マウスの脳では免疫系細胞を誘引する分子の発現量が増加していることが明らかになり、老化脳では骨髄由来細胞を積極的に呼び寄せている可能性が出てきた。
骨髄由来細胞の脳への進入という現象は、近年他の研究室からも報告されており、神経変性疾患や慢性的なストレス、全身の激しい炎症によって脳へ進入する細胞数が増えることもわかってきている。脳と免疫系はサイトカインや神経伝達物質を介して常に相互作用してからだの恒常性を維持しており、何らかの原因でそのバランスがゆらぐと、骨髄由来細胞がより多く脳に進入すると考えられるようになってきたのである。私たちは、ゆらいだバランスを元に戻す修復機能が老化脳では衰えているのではないかと想像しているが、証明はこれからだ。脳に進入する骨髄由来細胞の実態を明らかにすることで、加齢にともなう脳の変化とからだ全体の免疫系の密接な関わりが見えてくると期待している。
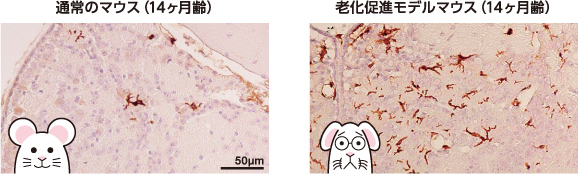
(図7) 骨髄由来細胞の脳への進入の加齢変化
茶色い部分は骨髄由来細胞。老齢の老化促進モデルマウスでは骨髄由来細胞が脳により多く進入する。

石井さなえ(いしい さなえ)
2006年東京大学大学院医学系研究科博士課程修了。博士(医学)。愛知県心身障害者コロニー発達障害研究所研究員、日本学術振興会特別研究員(RPD)などを経て、2015年よりペンシルバニア州立大学医学校リサーチアソシエイト。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)