RESEARCH
粘菌のふるまいに見る自己組織化の始まり
生きものの最大の特徴は、他からの制御なしに自分で自分をつくりあげる自己組織化です。飢餓に陥ると単細胞アメーバが集合し、多細胞体へと姿を変える「細胞性粘菌」から細胞の秩序形成の過程を探ります。
1.ミクロとマクロを往来する粘菌
多細胞体制の形成と聞いて、多くの方が思い浮かべるのは動物や植物の発生だろう。これらに共通しているのは、卵や種に蓄えられた栄養を用いながら受精卵が次々と分裂と増殖をくり返しながら個体が形成される点である。
しかし、生物界を広く眺めてみると発生には別の様式があることに気づく。分裂をくり返していた単細胞のアメーバが集まることで多細胞体制をつくるというものだ。その代表が、社会性アメーバと呼ばれる真核生物の細胞性粘菌である。粘菌は飢餓を引き金にアメーバ細胞の活動を停止し、集合して子実体となり次世代の胞子をつくる(図1)。こうした発生様式は、土壌中で進化した多細胞体制の特徴のようである。
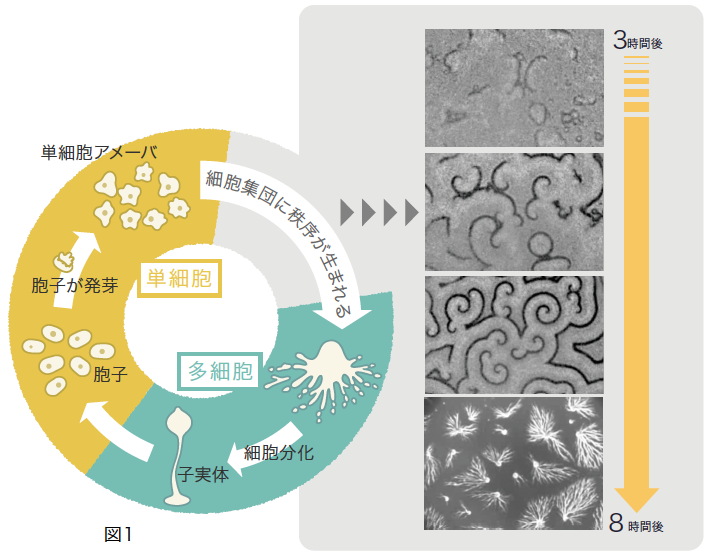
(図1) 細胞性粘菌の暮らし
次世代の胞子をつくるために単細胞アメーバが集合し、多細胞の子実体をつくる。
粘菌の生活史は、高校の生物学の教科書でなじみのものだが、いかに細胞が集合するかは説明されていない。飢餓状態が引き金となって、走化性誘因物質であるサイクリックAMP(cAMP)を外に放出するアメーバ細胞が生じ、そのcAMPを受けとった細胞が興奮してさらにcAMPを放出する。数百~数万もの細胞がcAMPをリレーし(図1)、その波に向かって集合して子実体を構築するのだ。この現象は、非平衡系(註1)における自己組織化の典型例であり、例えば化学反応におけるBZ反応(註2)に出現する振動や波と非常に良く似ている。
しかし、粘菌の場合は、均一な有機反応系とは違い、cAMPの波のパターンにズームアップしていくと、反応分子に行き着く前に、アメーバ細胞が見えてくる。そこには細胞運動や環境応答など一細胞の自律的なダイナミクスがあり、これと集団の形態形成ダイナミクスとの間に齟齬は見られない。
非平衡系の理解と、細胞の生体情報の手がかりとを元に、ミクロとマクロの動態が互いに影響を与えながら階層を超えて往来する粘菌の特性を丁寧に捉えることによって、生きものの自己組織化のしくみを理解できるのではないか。そう考えて挑戦を開始した。
(註1) 非平衡性
エネルギーや運動量において常に流れがある系を指す。例えば膨張する宇宙、星の内部に存在する温度勾配、あるいは地球上における 雲の形成や台風の発生など、自然界で見られる現象のほとんどは非平衡系である。逆に平衡系とは、作用する力がすべて均衡をとっている状態を指し、いつまでも動かない状態を保つ。
(註2)BZ反応
ベロウソフ・ジャボチンスキー反応(略してBZ反応)。金属塩と臭化物イオンを触媒としてカルボン酸を臭素酸塩によるブロモ化する化学反応。系内にあるいくつかの物質の濃度が周期的に変化する振動反応の代表例であり、自己組織化現象として広く知られている。
2.アメーバ社会のオーケストラ
サッカースタジアムの応援席でのウェーブを思い浮かべてほしい。これは、おそらく一人で始めることは難しいだろう。何人かが意図をもって、もしくはたまたま同時に立ちあがり、それに周りの観客が共感して席を立つのがきっかけとなる。その後は、さらに隣の観客が動きを予測しながら絶妙のタイミングで立ち上がることが途切れることなく伝播していくのである。このような同調的なふるまいが、粘菌の細胞集団でいかに出現するのだろう。
一つの可能性は、指揮をとる特定のリーダー細胞がcAMPの放出を繰り返し、それを受けとった周りの細胞が応答するというものである。二つ目は、どの細胞も特性は同じであり、細胞間での何らかの信号のやりとりの結果、cAMPを放出するということに全員が一致すれば一斉に応答するという可能性だ。前者が、独裁的にふるまうリーダーによって大衆が煽動される集団とすれば、後者は、民主的な決定に基づいていると言ってよいだろう。
アメーバ社会の意志決定はどちらの方法で行われているのだろう。この問いへの答えを得ようとして私たちが手にしたcAMPの応答ダイナミクスの描像は、すべて細胞集団に対する生化学的な分析に基づいていた。試験管に入れた細胞集団にcAMP刺激を加え、そこで合成されるcAMPを同位体によって測ることはできても、一つの細胞のふるまいを測定する技術はなかったからである。その上、cAMPを外部から加える前に、細胞内で合成されたcAMPが放出されてしまったり、細胞外cAMPが酵素によって分解されてしまったりして、正確なcAMPの定量が難しかった。
それを乗り越える工夫が必要であると考え、ほ乳類のcAMP結合タンパク質に蛍光タンパク質を結合したcAMPプローブを粘菌の細胞内で発現させ、これを生きたまま顕微鏡下で可視化することを試み、成功した(映像1)。幸い粘菌は、分子遺伝学的操作がやりやすいのでこれができたのである。ここで細胞一つを隔離し、細胞外からcAMPを様々な濃度やタイミングで与えれば、細胞内のcAMPの上昇のダイナミクスをより厳密に理解できると考えた。高感度カメラを用い、プローブの選択や励起光の波長などに工夫を重ねた結果、粘菌の発生にほとんど影響を与えることなく、長時間にわたってcAMPの濃度変化の測定ができるようになった。粘菌の研究に関わったことのある者にとっての50年来の夢の実現と言ってよい。
(映像1)
cAMPプローブを使うことで細胞内のcAMPが低濃度(緑色)から高濃度(オレンジ色)へと周期的に変化する様子を捉えることができた。
3.一細胞のふるまいを測定する
細胞内のcAMPを可視化できるようにした粘菌細胞一つを容器内に隔離し、灌流装置(註3)を使ってcAMPの刺激を加える実験をした。私たちがまず注目したのは、cAMPを含まない緩衝液を流した場合、細胞内のcAMPの振動はおろか、cAMP の発火(一過的な濃度上昇)すらほとんどみられないことである。もっとも辛抱強くデータを集めると、およそ1分間に0.0007回という極めて低い確率での発火は見られる。そこで、緩衝液にごくわずかなcAMPを加えたところ、この確率は若干上昇する。
外部から加えたcAMPの濃度が極めて低濃度(ピコモル)の場合、刺激が加えられたタイミングとは関係なく、細胞内のcAMPはランダムに発火するのである(図2)。ここから、あらかじめ指揮者としての役割を担う特定の細胞は存在しないことがわかった。
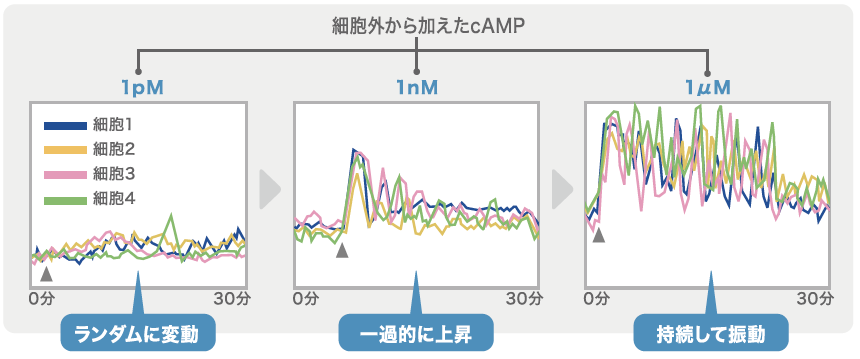
(図2) 細胞内のcAMPの変動
一細胞を隔離し、細胞内のcAMPの変動を測定した。外から加えるcAMPが低濃度だとランダムな変動しか見られないが、濃度を上げていくと、観察したほぼ全ての細胞でcAMPの上昇が確認できた。※▲はcAMPの刺激を加えたポイント。
さらに、細胞外のcAMPの濃度を高くすると(ナノモルレベル)、観察したほぼすべての細胞内のcAMPの濃度が、刺激が加えられてから1分ほどでピークに到達し、一度下がるが再び1分後に次のピークが現れるという応答をくり返す(図2)。ただし、このピークは徐々に下がり15分ほどで消える。次に細胞外のcAMPの濃度をマイクロモルレベルまであげると、減衰が見られず、細胞内のcAMPの濃度は周期的に変動(振動)をし続けるようになる(図2)。一見、この細胞は能動的にふるまう指揮者のようだが、振動は細胞外のcAMPの濃度が上がっているときにのみ見られ、緩衝液のみに戻すと細胞内のcAMPは元のレベルに戻ってしまうのだ。すべての細胞の特性は同じであり、外部環境に応じてふるまいを変える柔軟な能力を持っていることがわかった。
4.生まれながらの指揮者はいない
集団的な振動が出現するしくみも、灌流装置を用いて調べることができる。前述では細胞一つを隔離して応答を測定したのだが、今度は細胞数をどの程度増やすと集団内で自発的なふるまいが出てくるのかを見てみた。ここでは、外からcAMPを加えずに緩衝液を流しているだけであり、細胞外cAMPはそこにある細胞から放出されたものだけである。灌流装置の容器内に流す緩衝液の速度と細胞密度を様々に変えてみたところ、それが集団的なcAMPの発火頻度を変化させることがわかった(図3)。細胞密度を上げて、灌流速度を穏やかにするほど発火頻度が上昇し、5~6分に1回の周期になったところで安定した。集団的な発火頻度は、細胞の分布密度や細胞外cAMPの濃度などの周辺環境に依存していると考えられる。
細胞密度を上げて、灌流速度を穏やかにするほど発火頻度が上昇し、5~6分に1回の周期になったところで安定した。集団的な発火頻度は、細胞の分布密度や細胞外cAMPの濃度などの周辺環境に依存していると考えられる。
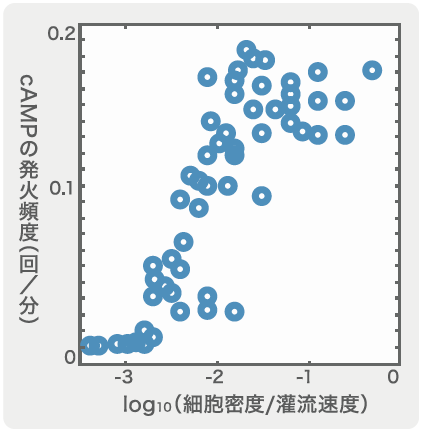
(図3) cAMPの発火頻度の変化
グラフの右側ほど細胞密度が高く、灌流速度が遅くなるため、細胞外のcAMPの濃度が高い状態にある。
また、集団的な発火がおこる付近の細胞内では、細胞外にピコモルレベルのcAMPが存在する時と同じランダムな発火を起こしていることもわかった。この状況を理論的に説明するために、一細胞レベルのふるまいを再現する式をたて、仮想的な細胞集団がどうふるまうかをコンピューター上の数値シミュレーションで再現したところ、個々の細胞がごくまれに発火して放出したcAMPが、他の細胞の発火を誘起することがわかった。この連鎖が一定以上になったとき、集団内で全細胞での一斉発火が生じるのである(図4)。
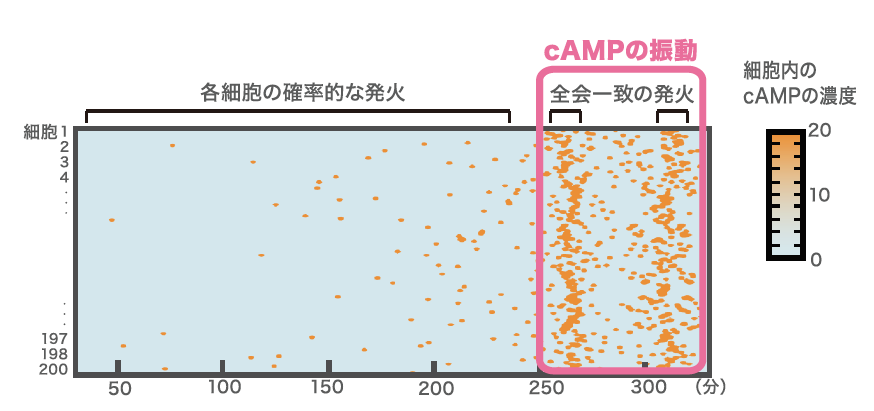
(図4)シミュレーションによる細胞集団のcAMPの振動
細胞200個のcAMPの発火をシミュレーションで再現したもので、個々の細胞のランダムな発火が連鎖的に蓄積されていった結果、全会一致の発火が生じることをわかる。灌流実験とシミュレーションから次のことが考えられる。cAMPが細胞外でたまりやすい場所ほど高頻度で発火するため、そのような場所から波が発生する。したがって始めはでたらめに波が始まり、競合しあうと考えられる。細胞外にはcAMP分解酵素も分泌されており、その量や細胞密度などの変動も細胞外 cAMPの濃度に影響する。じわじわと細胞外cAMPが上昇していく中で、より短い周期で発生する場所から伝わってきた波に細胞が応答するようになり、最初に波の周期が最短(5~6分)になるような状況に到達した場所が波の中心、つまり自己組織化の中心となるのだ。
予め指揮者はいないものの、細胞同士の相互作用の中から生じる動的な構造が指揮者となる。細胞集団によるcAMPの発火は、一細胞の閾値的なふるまいに単純に還元できない協同的な現象なのである。
5.環境が生み出す集団の秩序
単細胞生物から多細胞生物への進化は20回ほど独立して起きたとされている。自己複製する単位が集団化し階層を超えることで、新しい複製単位と選択対象が出現することを、Maynard SmithとSzathmaryは主要な移行(Major Transition)と呼んだ。遺伝子から染色体、原核細胞から真核細胞、細胞集団から多細胞体へというように、階層の移行を通じて、現在の生態系ができたというわけである。
多細胞生物の特徴として、一つ一つの細胞は比較的単純なふるまいしか示さないにも関わらず、集団になると高次の機能をもつことがあげられる。心臓や脳を分解してバラバラの細胞にすると、もはや器官レベルにあった性質の多くは消えてしまう。粘菌のアメーバ細胞は、一見主体性がなくバラバラに活動しているようだが、その中から共感し合えるものが出てきて、それが揃った結果、集団的な振動と波ができる。環境が自分たちをつくり、自分たちがさらに環境をつくるのである。綿密な理論と、定量的な測定でアプローチできる粘菌だからこそ、単細胞から多細胞体へと階層を超える際の一般的ロジックを明らかにできると考えている。
多くの要素を組み合わせて全体を作るとき、いかに集団の機能性を発現させ、制御できるかというテーマは、現在の科学にとって未解決であり、しかも乗り越えなければならない問題である。再生医療の幹細胞集団をどうあやつるか、複雑化するインターネットや人間社会をどう構築していくか。まず粘菌に始まり、生物にみられる階層的な動態を知ることから展開できることは多いだろう。
澤井 哲(さわい・さとし)
東京大学大学院総合文化研究科准教授。2001年東北大学大学院情報科学研究科博士課程修了。博士(情報科学)。2001-2005年プリンストン大学分子生物学部博士研究員、JST ERATO複雑系生命プロジェクト(総括:金子邦彦教授)グループリーダーを経て、2008年より現職。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)