RESEARCH
全体として生きる腸内細菌をはたらきで計測する
人間の体内に暮らす細菌のゲノムのDNA配列を一挙に解析したところ、お互いに影響を与えながら生きる有機体としての人間と細菌の姿が明らかになってきた。
1. 集団で暮らす細菌
地球を見渡すと、上空8000mから地中5000m、そして水深約11000mの海底火山付近まで、ありとあらゆるところに細菌が暮らしている。細菌は地球上でもっとも多種多様で多数を占める生物種であり、時に、「地球は微生物の惑星」とも呼ばれる。私たちの身体でも、皮膚や口腔、腸内などに細菌が見られ、腸内には約100兆個、重さにしておよそ1kgもの細菌が少なくとも数百種類常在している。これら、環境中の細菌の99%以上は、単離培養できないと言われている。通常、自然界の細菌は他の細菌と集団(叢)を形成して生息しているため、細菌同士や周りの環境との間の相互作用をする複雑で多様な生命システムをもち、単離培養の条件設定が難しいのである。
しかも、細菌叢の個々の構成細菌は集団の形成と維持のために機能を発揮するはずであり、その実体は分離した細菌を実験室で個別に解析する従来の方法では解くことはできない。共存する細菌の機能やその細菌叢が棲息する周りの環境状態を知ってはじめて理解できるものである。そこで、細菌叢を対象としたメタゲノム解析(図1)が注目を浴びることになる。
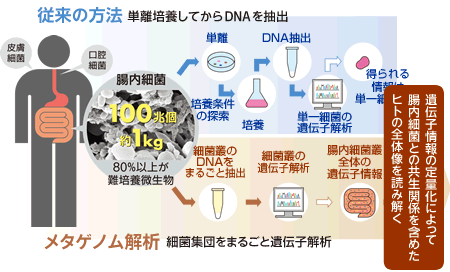
(図1) メタゲノム解析
2.環境の上に成り立つ生命現象を解き明かすメタゲノム解析
“メタ(meta)”とは“超越した”という意味のギリシャ語である。細菌叢を対象としたメタゲノム解析では、混在する多様な全細菌種のゲノム全体をひとつの集合体、つまりパンゲノム(Pan-genome)と言う概念で取り扱い、パンゲノムとしての構造や機能特性を解明する。分離培養をせずに直接細菌叢のゲノム全体を解析するのである。これまでの単離培養した個別細菌のゲノム解析よりも、はるかに多くの遺伝子やゲノムデータを取り扱うため、高度な計算機能力とバイオインフォマティクス技術が必要であるが、細菌種の組成、遺伝子の組成、環境との間にある相互作用等、実際に棲息している細菌叢の全体像の解明が可能となる。つまり、メタゲノム解析は「環境の上に成り立つ生命現象」を解き明かす道を切り開くものなのである。
私たちは、身体の内側でありながら、外の環境とつながっている腸内の細菌叢に興味をもち、そのはたらきを全体として捉えたいと考え、人間でのメタゲノム解析を行った。乳児から大人までを含む健康な日本人13人の腸内細菌叢ゲノム全体を調べると、それぞれ約2万~6万個の遺伝子が同定できた。そこから、菌種組成や個人差、他の環境に比べて特異的に増えている機能を調べたところ、腸内細菌とヒトとの関係が見えてきた。
3. 選ばれて暮らす腸内細菌
まず、得られたゲノム配列中にコードされていた腸内細菌の遺伝子配列を既知の遺伝子配列と比較して菌種組成を推定すると、少なくとも162属存在することが分かった。もちろん個人による組成の違いはあり、また乳児は食事をとれる子どもや大人と大きな差があった。大人の場合、ほとんどが納豆菌の仲間が含まれるファーミキューテス門やバクテロイデーテス門であるのに対し、乳児は一般にビフィズス菌なども含まれるアクチノバクテリア門が多い。
一方これまでに、16SリボゾームRNA(16S)遺伝子の配列データ(約1,500塩基長)を用いてヒト腸内細菌叢の菌種組成の解析が多くの研究者によって行われている。細菌叢を構成する各細菌種の16S遺伝子は共通プライマーを用いたPCR(註1)によって一括して増幅でき、増幅したDNAのクローニング(註2)と配列決定によって、細菌を単離培養せずにそれぞれの16S配列データを得ることができる。16S遺伝子は地球上の全ての細菌種が有しているので、その配列類似度は菌種組成の解析や細菌の系統分類を行う指標となっている。この方法で、これまでにさまざまな環境から100門近くの細菌種が同定されているが、腸内細菌叢はこのうちのわずか9門の真正細菌と1門の古細菌だけに限られている(図2)。これは、腸内細菌叢が強い選択圧の下に形成されてきたことを示唆する。腸管内部は嫌気的であり、しかも腸に達するまでに口腔と強酸性の胃を通過しなければならない。また、腸管上皮細胞との接触、限られた食事成分をエネルギーとした生存など、ヒトの生理機能が大きく関与した結果が現在の細菌叢になったのだろう。
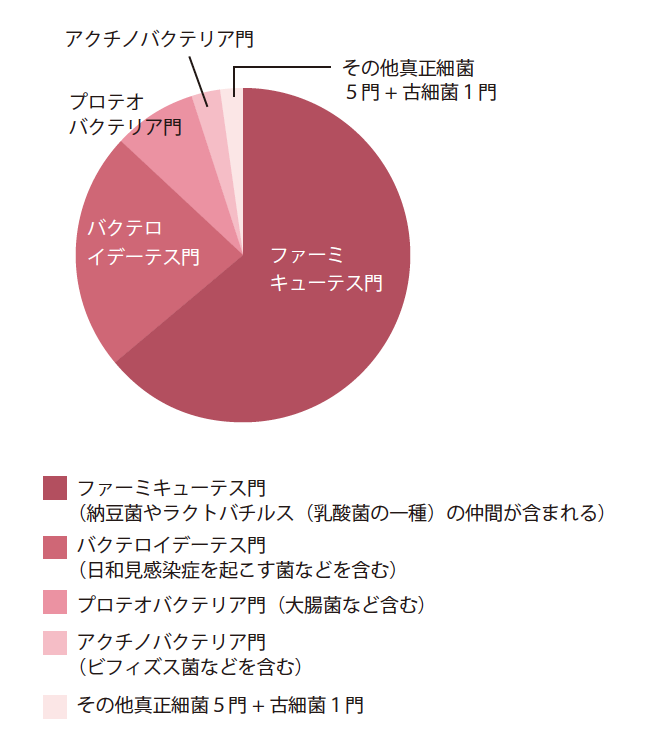
(図2) 最新の腸内細菌の菌種組成(門レベル)
16Sリボソーム遺伝子を45,000以上使った解析では細菌が9門、古細菌が1門見いだせた。
以上のように、16S配列データ解析は菌種の同定や分類にとっては強力な解析手法であるが、そこからは遺伝子の機能情報は得られない上に、せっかく同定した菌種の大部分が培養困難であるため、細菌の機能解明がしづらいのが難点である。つまり、機能に直結した遺伝子を明らかにできるメタゲノム解析は、この限界を打破する唯一の方法なのである。
(註1) PCR法
Polymerase chain reaction法の略で、一定のDNA塩基配列を増幅するための手法。耐熱性のDNA合成酵素を用い、対象の鋳型DNAを指数関数的に増幅することができる。
(註2) クローニング
遺伝子などのある特定のDNA塩基配列を分離すること。主に大腸菌などの宿主細菌に、目的の遺伝子を組み込んだベクター(遺伝子の運び屋の核酸分子)を導入し、宿主細菌を増やした上で目的の遺伝子を分離する方法。
4.一人一人異なる腸内細菌叢
13人それぞれの腸内細菌叢は、一人一人の指紋として扱える可能性を感じられるくらい異なっていた。特に、母乳もしくはミルクを飲んでいる乳児では、その違いが大きく、中には土壌に近い細菌叢をもつ個体もあった。それに対して、大人や子ども(離乳後の人)は比較的お互いに似ており、離乳後に腸内細菌の種類がある程度の幅を持って固定されているようである(図3)。従来、同一の食事をとる機会の多い家族内では互いに類似した細菌組成をもち、それが親から子へと受け継がれると考えられていたが、家族の中や親子間での有意な類似性はみられず、個人独自の組成が形成されていた。これらのデータは、腸内細菌叢の形成機構や由来を解明する上での新たな視点となる。たとえば、離乳食に含まれるわずかな細菌がその赤ちゃんの腸内に離乳期間を通して少しずつ定着する、つまり、離乳食が大人タイプの細菌叢の形成に大きく関与するのかも知れない。この場合、その子供の両親も同様にそれぞれの乳児時期に別々の離乳食をとるので、親子間も夫婦間も類似した細菌叢にはならない。このことは、一度離乳時に形成された腸内細菌叢は、その後の食事によって大きく変化しないことが仮定となる。事実、健康な大人の腸内細菌叢は調べた数ヶ月から数年間、ほぼ同一であるという多くの報告がある。もし、離乳食が腸内細菌の形成の主要因であれば、同じ離乳食をとる可能性の高い双生児やあまり年差のない兄弟姉妹、さらには偶然同じ離乳食をとった他人同士においても有意に類似した細菌叢をもつかも知れない。
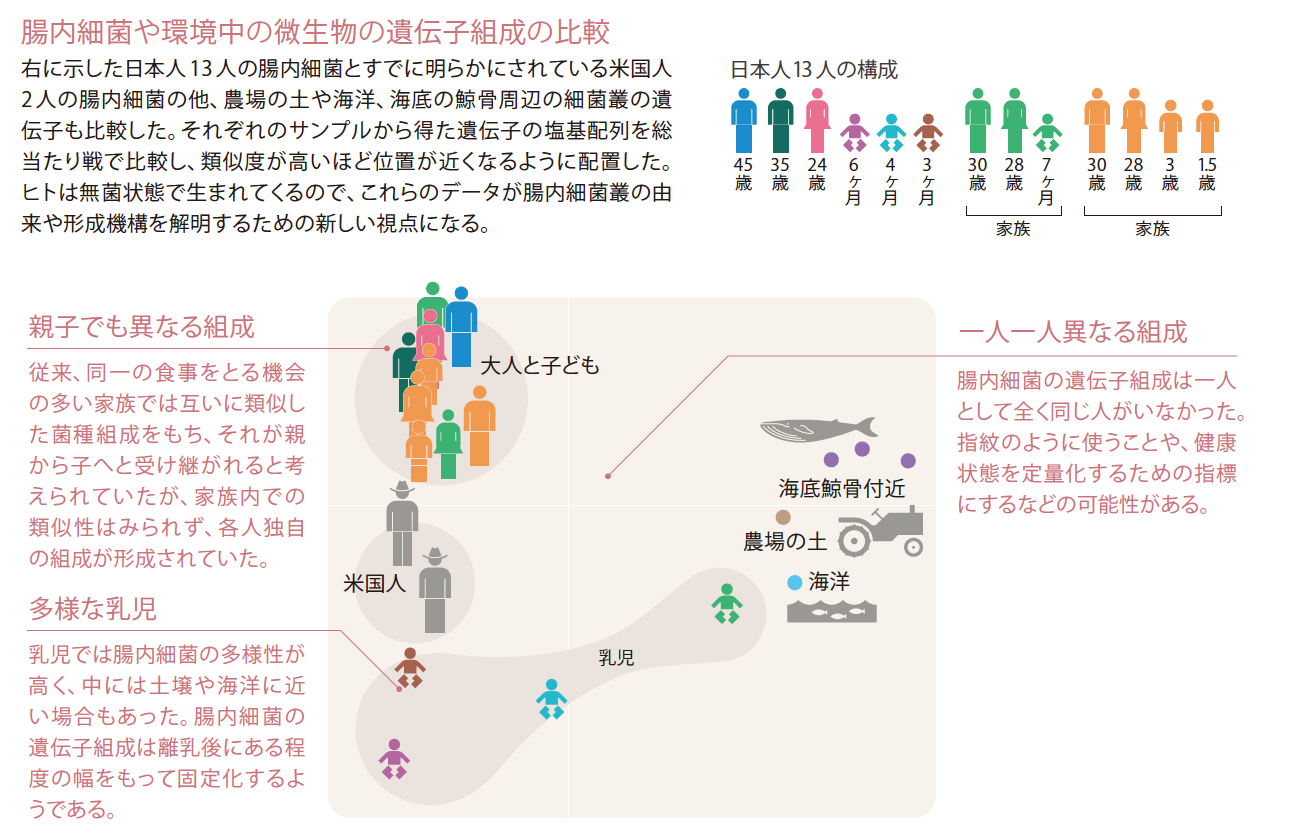
(図3) 腸内細菌や環境中の微生物の遺伝子組成の比較
5.腸内細菌叢のはたらき
次に、ヒトの腸管以外の環境から得られた細菌叢と比べて腸内細菌叢で多く見られる遺伝子群を探索した。その結果、大人や子どもでは237個、乳児では136個の遺伝子群が高頻度で存在することがわかった(図4)。
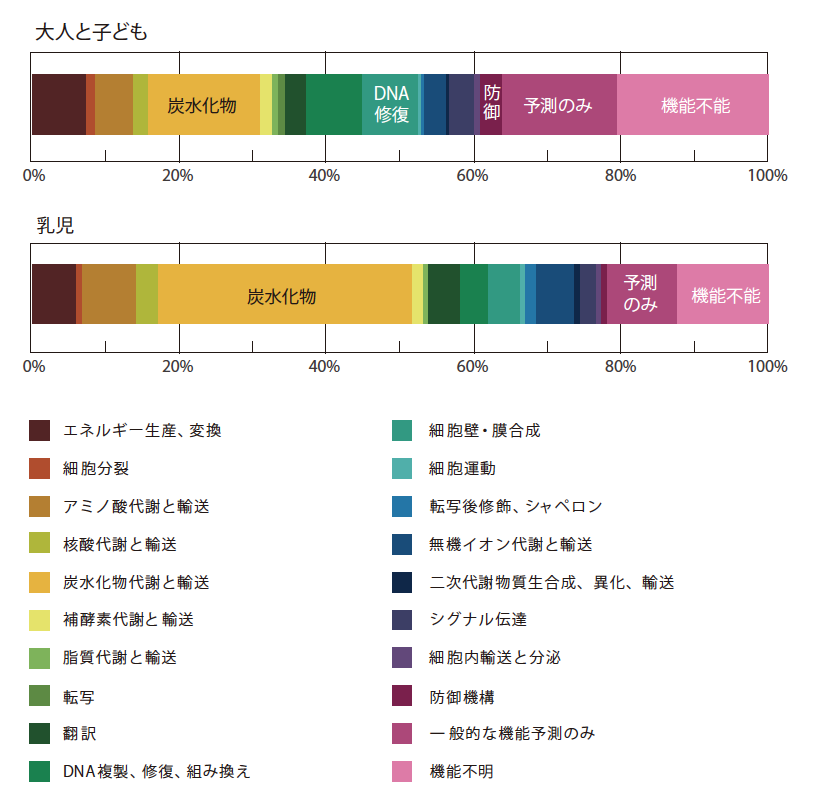
(図4) 他環境に比べて腸内で多く見られた遺伝子群の割合(%)
大人や子どもでは、食物中に含まれるでんぷんなどの植物由来の多糖類を分解する酵素が多い。腸内細菌叢はヒトが代謝できない糖類をおもなエネルギー源とし、その代謝物であるビタミンや短鎖脂肪酸などをヒトに供給しているようだ。一方、脂肪酸代謝に関わる酵素が外部環境に存在する細菌より少ないのは、ヒトが脂肪酸代謝に関わる酵素をもっているからだろう。ヒトと腸内細菌との間で、食べものからのエネルギー獲得に関して機能の分業、つまり共生関係があることが明らかになった。さらに、大人と子どもでは、DNAの修復や殺菌物質への防御などに関わる遺伝子も多く見られた。私たちの腸管には食べものの成分や宿主(ヒト)細胞、腸内細菌自身に由来する代謝物としてDNAを傷つけるもがかなり含まれているのだろう。乳児では多糖分解酵素がほとんどみられず、代わりに母乳等に多く含まれる低分子の糖やビタミン等を取り込む遺伝子が増えていた。ここからも、腸内細菌叢がどのような機能をもつものになるかは、私たちが日々摂取する食物中の成分を大いに反映していると考えられる。このほか、他の環境細菌叢に比べて著しく少ない遺伝子群もいくつかあった。例えば運動性に関わる鞭毛形成や化学走性の遺伝子群である。腸管にはぜん動運動があるので、腸内細菌は栄養に向かって移動する必要がないからだろう。しかも鞭毛が宿主免疫系の抗原になり、過剰な炎症を起こして宿主(ヒト)からの攻撃を受ける危険もあり、それを避けるためにはない方がよい。つまりこれは、常在菌としての環境適応の一端を示していると言っても良い。
6.超有機体としてのヒト
ヒトは、自身がもつ機能と腸内細菌叢の機能が合わさった“超有機体”とも言える(図5)。今回の、腸内細菌叢メタゲノム解析で浮かび上がった特徴的な遺伝子機能は、腸内細菌が宿主であるヒトの進化に適応するように獲得してきた結果であろう。まだ始まったばかりの研究だが、手元の大量のデータの中に、生きものの進化や、共生の物語はもちろん、炎症性腸疾患、大腸がん、肥満、アレルギーといった腸内細菌が関与する疾患の発症機構を解く鍵もたくさん埋まっている。疾患研究には腸内細菌遺伝子とヒト遺伝子をつき合わせて全体の機能を見ていかなければならない。新分野の開拓を楽しみながら努力を続けている。
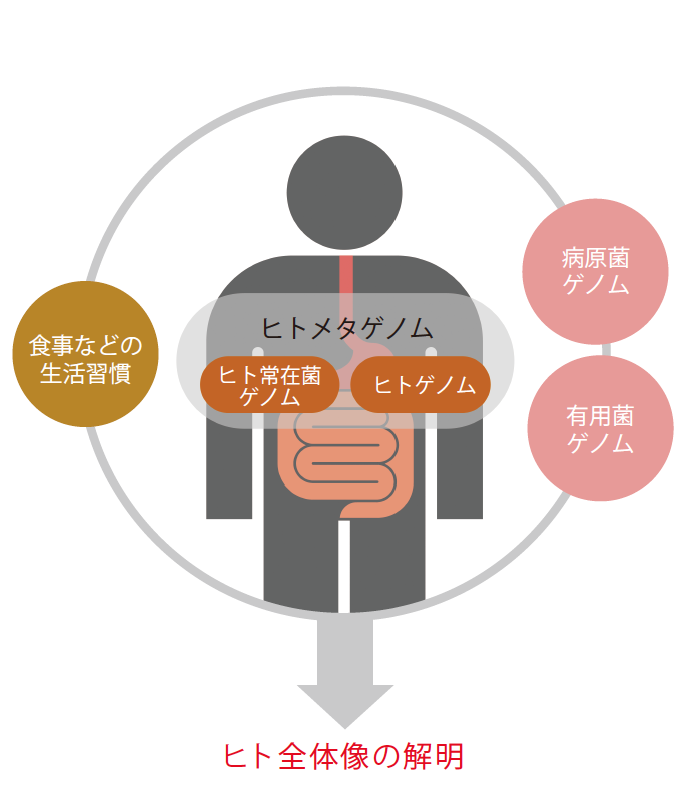
(図5) 共に影響を与えながら生きる有機体としてのヒトと細菌
健康や病気を含めたヒトの全体像の理解のためには、ヒトの内外の環境として常在菌を含む細菌について知る必要がある。
服部正平(はっとり まさひら)
1979年 大阪市立大学大学院工学研究科博士課程修了、工学博士。東亞合成化学工業(株)研究員、九州大学遺伝情報実験施設助手、米国スクリプス研究所及びカルフォルニア大学サンディエゴ校研究員、東京大学医科学研究所ヒトゲノム解析センター助教授、理化学研究所ゲノム科学総合研究センターチームリーダー、北里大学北里生命科学研究所教授を経て、2006年より東京大学新領域創成科学科教授。現在オーミクス情報センター長を併任。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)














