RESEARCH
大腸菌の極で鼻のようにはたらくセンサー
大腸菌はべん毛を使い、よりよい環境へ移動します。
好きなもの、嫌いなものを感知するセンサーである受容体が菌体の極に集まり、わずかな変化に反応し、刺激をべん毛へ伝えます。
この「鼻」のようなしくみは、生物の行動を支える分子のはたらきを知るよい材料です。
1.はじめに
大腸菌は、分子生物学の始まりから「モデル生物」として詳しく研究されてきたため、あらゆる生物種の中でもっとも理解が進んでいる。とはいえ、この小さくて一見単純そうな大腸菌でさえ、まだまだわからないことだらけであり、「生命とは何か」という最も基本的で大事な疑問を解くために研究することがたくさんある。今回は、大腸菌のもつ能力の一つである走化性のしくみに注目し、その研究で見えてきた大腸菌細胞の形づくりを紹介したい。形づくりというとどうしても多細胞生物に眼が向くが、細胞そのものがどのようにしてできるかを知ることも大事である。
2.バクテリアの示す高度な行動
生きものは、常に環境の変化を感知し、それに対処して生きている。特にバクテリアの場合、温度や栄養条件、pH、浸透圧、集団密度などの外環境が大きく変化するので、それに適切に対処できなければ生き残れない。大腸菌がもつ環境応答のうち、最も解析が進んでいるものの一つが走化性である。走化性とは、アミノ酸や糖などの栄養物質(誘引物質)に向かって近づき、金属イオンやインドール(註1)などの有害物質(忌避物質)から遠ざかる性質のことである。
分子生物学では、大腸菌を研究材料にしていながら観察したことのない人が多いようだが、是非観察して欲しい(暗視野顕微鏡法(註2)が観察しやすい)。まっすぐ泳いでは方向転換し、またまっすぐ泳ぐことをくり返している。単なるランダムウォークをしているだけのように見えるが、この行動が実は走化性の基本なのだ(映像1)。
(映像1) 大腸菌の泳ぎ回る様子
大腸菌は数本のべん毛をもち、根元にあるべん毛モーターを回転させながら泳ぎ回っている。べん毛が左回転すると束ねられてスクリューのようになり、推進力を得て直進する。一方、右回転すると束がほどけて方向転換をする。左右の回転の切り換えは自発的に起きているが、誘引物質があると、その切り換え頻度が変わり、直進と方向転換を組み合わせて試行錯誤的に正しい方向へ移動していく(図1)。
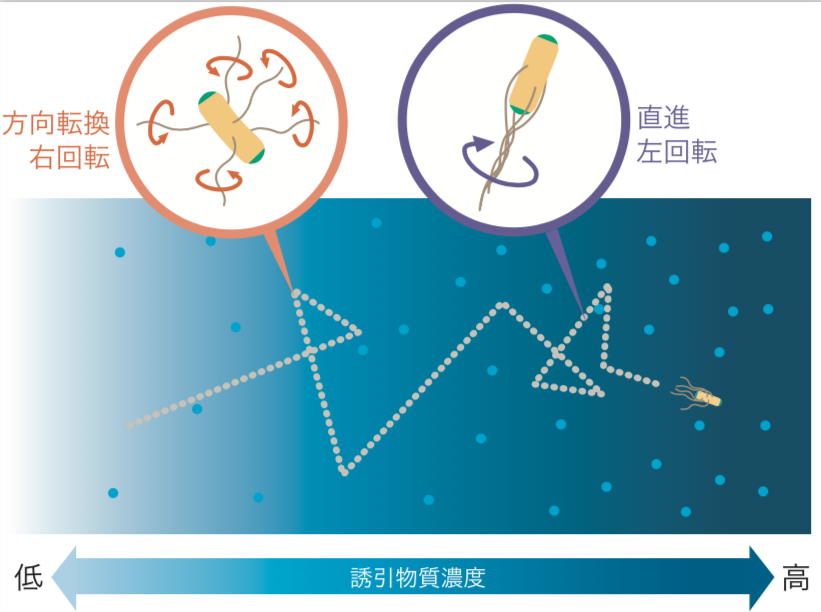
(図1)
大腸菌はべん毛が左回転すると直進し、右回転すると方向転換する。
偶然、誘引物質の濃度が高い方へ進んだときには方向転換の頻度が下がり、逆に低い方へ進んだときには方向転換の頻度が上がる。その結果、次第に誘引物質の濃度が高い方へ移動することができる。
大腸菌は体長約5μmと小さいため、菌体の前後で物質濃度の差を直接比較することはできないが、液体中を毎秒10-20μmの速さで素早く泳ぎまわることで、自分の周りの刺激物質濃度の時間変化を感じている。つまり、菌は少し前に自分がいたところの刺激物質濃度を「記憶」していて、それを現在の濃度と比較して行動を決定しているのである。
(註1) インドール
タンパク質の腐敗などによって生じる有機化合物。不快な臭い(大便の臭い成分に含まれる)を発するが、非常に低濃度の場合は花のような香り(オレンジやジャスミンなど)がする。
(註2) 暗視野顕微鏡法
試料へ斜めから光をあてて、試料により散乱した光を観察する方法。暗い背景の中で試料が光って見える。
3.高感度多機能センサーのはたらき
上記のような走化性に多くの研究者が魅了され、精力的に解析が進められた結果、現在では、物質を感知する受容体からべん毛の制御に至るまでの情報伝達に関わるタンパク質がすべて知られている。
さまざまな外的刺激を認識する走化性受容体は、細胞膜上にある膜貫通型の2つの細長いタンパク質が対になったホモ二量体で、細胞質側にはヒスチジンリン酸化酵素CheAが結合しており、それがべん毛モーターに情報を伝達する(図2)。
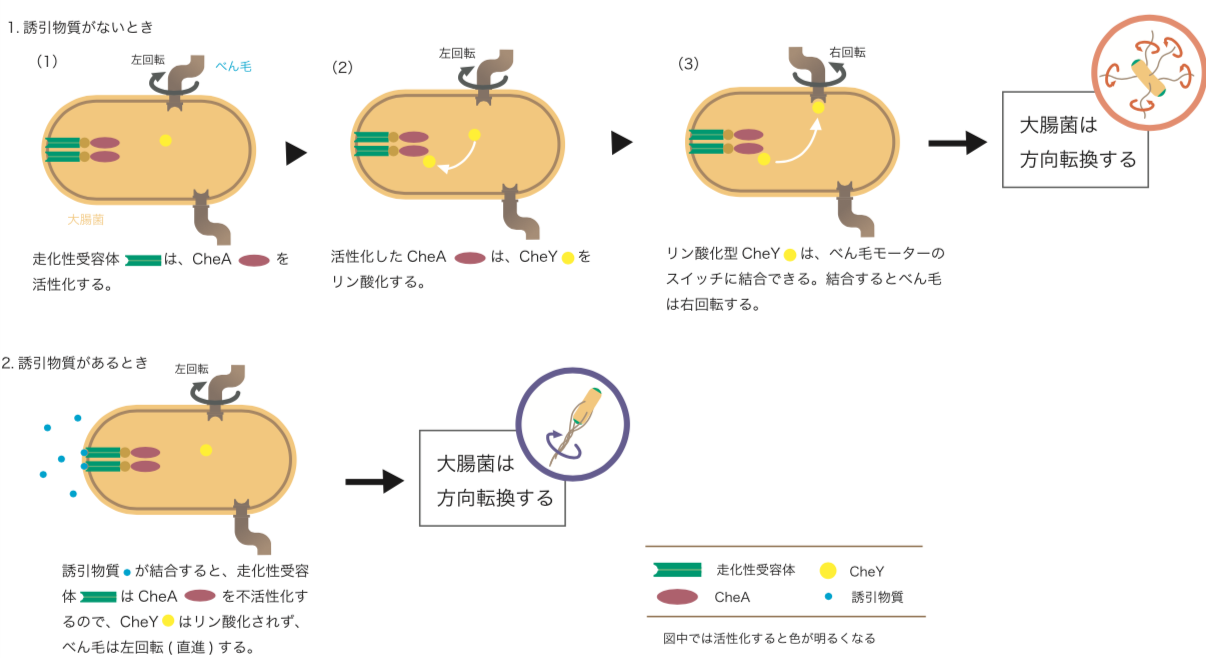
(図2)
大腸菌の情報伝達システム。
誘引物質の刺激がないときは、CheAが活性化されており、細胞内にある応答調節因子であるCheYのアスパラギン酸残基をリン酸化し、リン酸化したCheYがべん毛モーターの右回転(方向転換)を起こすのである(図2:1.誘引物質がないとき)。つまり、細胞は方向転換してその場を離れようとするのだ。逆に誘引物質が受容体に結合すると、CheAは不活性のままで、リン酸化型CheYの濃度が下がり、べん毛モーターは左回転(直進)する(図2:2.誘引物質があるとき)。つまり、今の方向へ泳ぐのがよいと「判断」するわけだ。
先ほど「記憶」と呼んだ、大腸菌の移動前と移動後の刺激物質の濃度差を感じるしくみも、受容体が担っている。一定の刺激が持続すると受容体が応答しにくくなるという性質により、刺激物質濃度の時間変化を検出できるのだ。この時、応答能の変化は、受容体タンパク質の複数のアミノ酸残基が受ける可逆的なメチル化の度合いで調整されている。受容体がCheAを活性化するにはメチル化が必須で、受容体からメチル基が完全にはずれてしまうとCheAは活性化されない。受容体が誘引物質の刺激を受けると、前述したようにCheAの不活性化が起こるが、同時に受容体のメチル化を進行させる経路がはたらくので、CheAは再び活性化し始める。すなわち、誘引応答のシグナルが打ち消され、一定の刺激に適応した状態になり、次の濃度変化に応答できるのだ。小さな細胞が餌に向かって走るという一見簡単そうに見える行動も、このように細かな調節の組み合わせで支えられていることがわかってきたのである。
4.大腸菌に「鼻」がある?
走化性の分子メカニズムは、このように解明されてきたが、情報伝達系を構成する個々のタンパク質分子の構造や性質がわかっても、それらが集合してできるシステムのはたらきは、必ずしもわかったとは言えない。「細胞は、どのように細胞外の情報を受け取り、細胞内へ伝え、処理するのか」、生命現象理解における基本的課題がここにも存在する。例えば、走化性受容体のアスパラギン酸に対する解離定数Kdの値は約1×10-6Mなのだが、菌はそれの100分の1という低い濃度、つまり~3×10-8Mのアスパラギン酸に応答し、アスパラギン酸のついている受容体が1%以下でも応答できる。つまりシグナル増幅が起きているのである。受容体が、細胞膜内でばらばらに存在しているのではなく、細胞の極に多く集合していることで何らかの共同性を示し、増幅が起こるのだろうと考えられている(図3)。
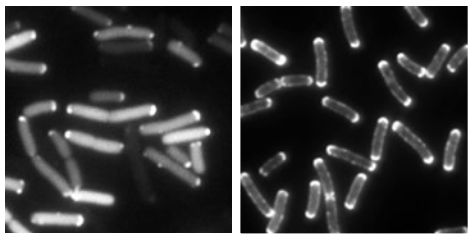
(図3)
受容体の極局在を示す蛍光顕微鏡画像。蛍光タンパク質GFPで標識した受容体遺伝子を発現させた。どの菌も受容体が極に集まっているのがわかる。なお、電子顕微鏡下による観察では、受容体が片極に多いことが観察されている。(右)受容体脱メチル化酵素CheBの片極局在を示す蛍光顕微鏡像。受容体と結合している情報伝達系タンパク質CheAなども片極に局在するものが多く見られる。
極に高性能なセンサーが集積しているということで、発見当初「大腸菌にも鼻がある?」と話題になった。「分子が集まったときに、生物として重要な性質が、どの階層でどのように現れるのか」という大きな疑問について実験的に取り組むには、システムを構成している素子が詳しく解析されている大腸菌の走化性は、非常に有利な系だと考えている。
では、この「鼻」=「受容体集団」はどのようなしくみではたらくのだろう。今のところ、さまざまな実験から大腸菌の極の受容体は、単なる集合体ではなく、受容体3つでひと組となった“二量体の三量体(六量体)”が、規則正しく配列したクラスターとなっているというモデルが出された(図4)。
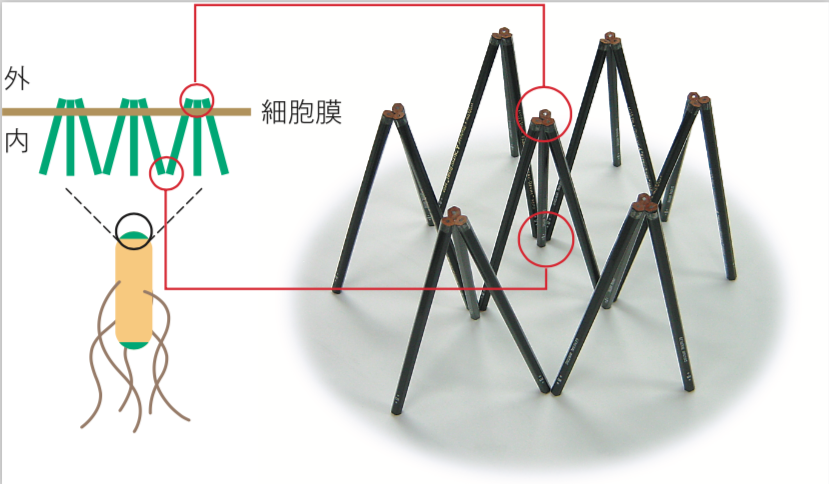
(図4)
右写真では、鉛筆1本がホモ二量体からなる走化性受容体1つを表している。受容体は細胞膜の外側でも内側(細胞質側)でも3つでひと組となり、規則的に配列してクラスターとなる。
最近、クラスターを可視化し、条件によってはそれが極の1割以上もの領域を占めることを示す結果が他の研究グループから報告されている。受容体どうしが会合部分で相互作用しているので、一部の受容体がアミノ酸と結合すると、そのまわりのアミノ酸の結合していない受容体も巻きこんで反応すると考えている。また、細胞質の情報伝達系タンパク質はすべて受容体クラスターに(少なくとも一時的には)結合することが報告されている。つまり、大腸菌の極には受容体クラスターを核とした超巨大分子集団があり、一種の細胞小器官として、効率のよい情報伝達を可能にしていると考えられるのである。
5.「鼻」はどのようにできるのか
ところで、受容体はどのようにして細胞の極に局在するのか。これについては、ほとんどなにもわかっていない。そこでまず、細胞質でつくられた走化性受容体が最初から極付近の細胞膜に挿入されるのか、細胞膜の別の場所で挿入されたのち極へ移動するのかを明らかにしようと試みた。走化性受容体に緑色蛍光タンパク質GFPを融合させ、厳密に制御して発現させると、菌体側面の細胞膜で蛍光が観察された(図5)。

(図5)
蛍光顕微鏡で観察した受容体(白色)。細胞質でつくられた受容体は、まず側面の細胞膜に現れ、80分後にはほぼ極に集まっている。40分後と60分後には等間隔に並んで見える。
このことから、受容体が菌体側面の細胞膜に挿入された後、極へ移動すると考えてよかろう。菌体側面での挿入は等間隔に見えるので、規則的な配列があるのではないかと考え、デコンボリューション法(註3)によって、蛍光像を三次元像に再構成した結果、らせん状に配置されていることが明らかになった(図6)。
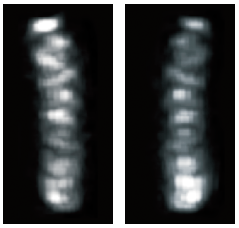
(図6)
デコンボリューション法を用いて、三次元像に再構成した。受容体がらせん状に配置されているのがわかる。右写真は左写真と同じ細胞を別の角度からみたもの。
走化性受容体は、一般的なタンパク質輸送装置によって細胞膜に挿入されることがわかっている。これまでタンパク質輸送装置は、細胞膜上に一様に分布していると考えられてきた。しかし近年、大腸菌などの細菌にも、細胞分裂や形の維持などにはたらく細胞骨格系タンパク質が存在し、らせん状の線維を形成していることが明らかになっているので、タンパク質輸送装置もらせん状に配置されている可能性を考えて調べてみたところ、まさにらせんを示した。
細胞骨格系タンパク質は、真核生物の細胞骨格を構成するアクチンと相同なタンパク質で、これがないと大腸菌は丸くなってしまう。細胞の形態維持に重要な役割を果たしているのだ。しかし、この細胞骨格系タンパク質のらせんとタンパク質輸送装置の配置を示すらせんは一致しなかったため、さらに詳しく観察したところ、タンパク質輸送装置によって膜に挿入された受容体は、すぐ拡散せずにタンパク質輸送装置と共局在している。ただし、何らかの構造に固定されているわけでなく、活発に動いているようだ。観察からは、受容体がらせんの軌道に沿って徐々に極へ移動すると考えてもよさそうだ。
(註3) デコンボリューション法
蛍光画像からピントの合っていない部分をコンピュータ処理で取り除いて鮮明な画像にする技術のこと。焦点面を少しずつずらした画像をたくさん撮影してこの処理を行なうことによって得られた像を三次元的に再構成する。
6.細胞というシステムの理解
受容体が極へ集まる過程の解明は、細胞というシステムの理解につながる重要なアプローチだと思っている。これまでの研究で、細胞内で分子を適切に配置し、組織化する構造の存在が示唆された。このような「超分子システム」全体のはたらきを分子の言葉で理解したい。これは「鼻」を超えて、大腸菌細胞の「なりたち」に関わる大きな問題だからである。たった数μmという小さな大腸菌の細胞はどのように組織化されているのだろうか。これは細胞というシステムの理解につながる興味深いテーマである。
川岸郁朗(かわぎし いくろう)
1990年東京大学大学院理学系研究科博士課程修了、理学博士。米国エール大学博士研究員、名古屋大学理学部助手、名古屋大学大学院理学研究科助教授を経て、2007年より法政大学工学部生命機能学科教授。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)














