RESEARCH
共生の生まれる過程に見る
生きものの柔らかさ
森の木陰に暮らす細胞性粘菌と腸内細菌の大腸菌を同じ容器で育てると、粘菌が大腸菌を食べ尽くし、共に絶滅に向かいますが、そのうち両者が共存するコロニーを生じます。危機に陥った時、共生の道を生み出す振る舞いは、生きものが38億年続いたことを支える戦略の一つでしょう。
1.生きものと機械の違い
機械を使っていると、その融通の利かなさにがっくりすることがある。機械と生きものは物質から出来上がっている点ではよく似ているが、その効率と柔軟性には大きな差がある。コンピュータは、生きものとは比較にならないほど高速で計算をこなし、答えを返す。これは、決まった入力(外部刺激)に対してどのように応答すべきかがあらかじめ組み込まれているからである。機械は、外部刺激に対して目的にあった応答をするように作られており、その限りでは効率がよいが、柔軟性には欠ける。機械に想定外の入力をすると、止まってしまうし、時には壊れてしまうことがある。
一方、生きものは、仕事の効率や速さは機械に及ばないが、予期せぬ外部環境の変化や刺激に対してしなやかに振舞う。人間の場合、少しぐらい言葉を間違っても、相手は何とかこちらの意思を理解しようとして答えを返してくれる。「石頭!」と怒鳴りたくなる人もいるが、コンピュータと比較すれば、ずっと柔らかい。このような柔軟な応答こそ生命システムの特徴といってよいであろう。
予期せぬ環境変化や外部刺激に対する柔軟な応答はどのように実現されているのであろうか? 我々が行った2つの実験、「大腸菌と細胞性粘菌との共生関係の構築」と「人工遺伝子ネットワークを導入した大腸菌の環境応答」とを通して、生きものの柔軟性の秘密を議論したい。
2.捕食―被食関係がいつの間にか共生関係に
生きものの共生関係は、過去に全く遭遇したことのない二種の生きものが同じ環境に突然現れることから始まる。それぞれの生きものは遺伝子代謝ネットワーク(註1)を変化させて、未知の生きものという新しい環境に柔軟に適応しなければ生き残れない。この環境変化は過去に経験したことがないので、それに対応する遺伝的プログラムや分子機構はこれまで使われたことはない。これがあらかじめ用意してあるのか、または組み立てられるのか。予期せぬ環境変化に対してどのように適応するのだろうか?
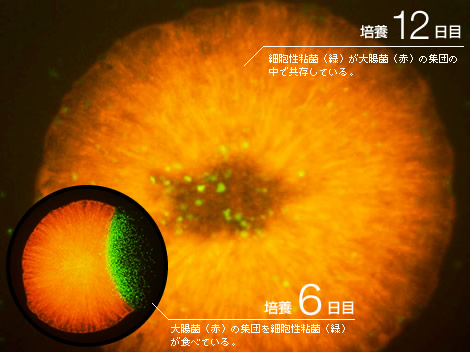
2種の生きものをシャーレの上で混ぜて飼ってみた。細胞性粘菌と大腸菌である(図1)。前者は森の木陰で、後者は哺乳類の腸内で独立に進化してきた生きものである。両者を同じ貧栄養固体培地の上で混ぜて培養すると、先に大腸菌が増殖し、粘菌がそれを食べて成長する。この時点では、捕食―被食関係にあるが、しばらくすると個々の粘菌細胞は究極の選択を迫られる。大腸菌を食べなければ餓死するほかないし、大腸菌を食べ尽くせば、餌がなくなって集団全体が絶滅してしまう。実際に2週間程度で、大腸菌も粘菌も見かけ上ほとんど絶滅、または仮死状態になった。ところがここで、大変興味深い現象が現れた。絶滅が起きたと思われたシャーレの上で、くずあん状の盛り上がった粘性コロニーが数個現れたのである(引用文献-1)。その粘性コロニーを詳しく調べてみると、その中では大腸菌と粘菌が増殖しながら共存していた。大腸菌は粘菌から栄養分をもらい、粘菌は増殖した大腸菌を食べる共生関係が出来上がっていたのだ。コロニー内の成分を調べてみると、それぞれの細胞を単独で培養した時には見られない多糖類を大量に含んでいることがわかった。また、粘菌はその大きさを半分程度まで縮め、大腸菌は繊維状につながって数倍の大きさになっていた。
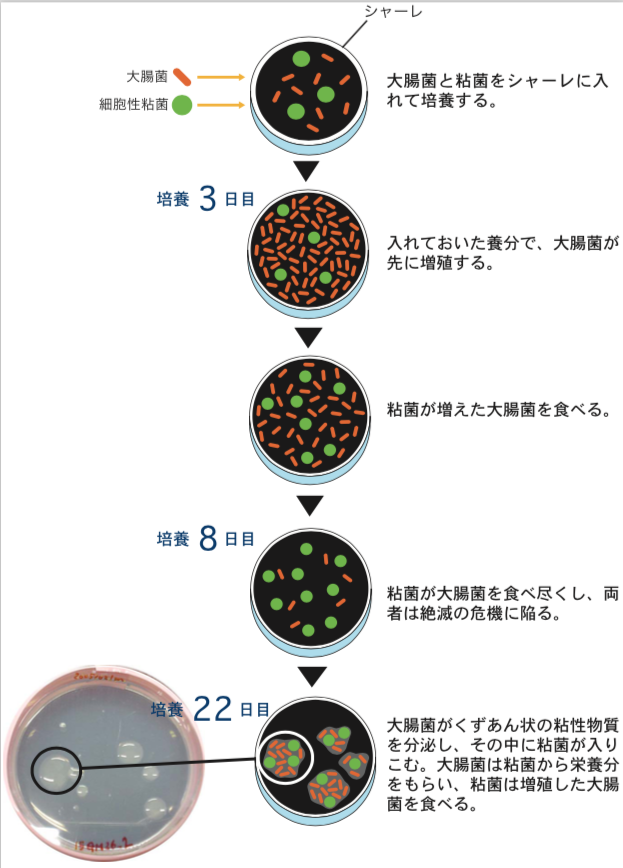
(図1) 共生関係が生まれるまで
共生関係ができる前と後の大腸菌それぞれからmRNA(註2)を取り出し、遺伝子発現(註3)解析をしたところ、共生関係が生まれた後では、すべての遺伝子の21%で発現量が増加し、15.6%で減少していた。発現が増加していた遺伝子の中には、嫌気性代謝系、糖透過―多糖類合成系(粘性物質をつくることに関係しているのではないかと思われる)、トランスポゾンがあり、減少している遺伝子の中には、解糖系、DNA―RNA合成系、ストレス対応に関するものがあった。エネルギーや物質生産を抑えて共生状態になったと解釈できる。興味深いのは、共生関係が出来ることによってストレスから開放され、安定な状態に変化しているように見えることである(引用文献-2)。 共生関係が生まれる過程では、大腸菌の柔軟性が大きな役割を果たすことが分かった。大腸菌の遺伝子発現の強さをみる指標として、大腸菌のゲノムに蛍光タンパク質をつくるGFP(註4)(Green fluorescence protein)遺伝子を組み込み、細胞ごとに蛍光の強さを調べてみると、同じ環境で育ったにも関わらず、遺伝子発現が弱いものから強いものまで10倍程度のばらつきが見られた。これは、細胞内の状態が遺伝子と環境だけでは決まらず、常にゆらいでいることを示している。粘菌と遭遇する前から、大腸菌の中には、ゆらぎによって蛍光タンパク質をつくる遺伝子を強く発現している細胞が非常に稀に存在し、共生関係が生まれる過程でそれが増えてきているのだ(図2)。大腸菌には、普段から遺伝子発現を10倍程度ゆるがす柔軟性があるからこそ、共生関係をつくり出す状態を稀に取ることができたのだろう。GFP遺伝子を強く発現している細胞だけを取り出すと、共生関係をつくりやすいという事実がこの考えを支持している。(山田ら、投稿中)
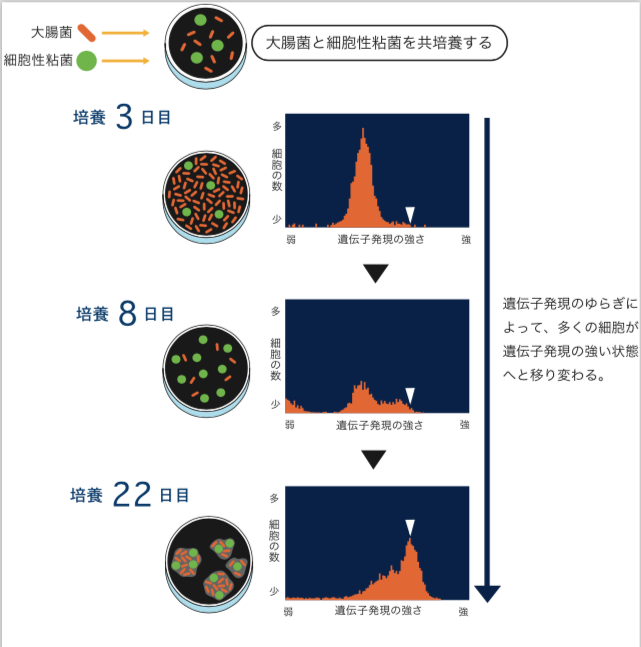
(図2) 共生関係が生まれる過程でのゆらぎによる大腸菌の遺伝子発現の変化
(註1) 遺伝子代謝ネットワーク
生体内の代謝効率によって変化する遺伝子発現(註3)のネットワーク。
生きものは、その代謝効率によって様々な遺伝子発現状態を示し、常に同じ遺伝子から同じ量のタンパク質が常につくられるとは限らない。
(註2) mRNA
DNA上の遺伝情報は、まずメッセンジャーRNA(mRNA)という形でRNAに写し取られ(転写)、それがタンパク質のアミノ酸配列へと翻訳される。
(註3) 遺伝子発現
DNA上の遺伝情報がmRNAやタンパク質などの遺伝子産物の形に表現されること。
(註4) GFP(Green fluorescence protein)
細胞を生きたままの状態で染色する蛍光タンパク質。
3.人工遺伝子ネットワークで大腸菌の臨機応変さを試す
単細胞生物は世代時間が短いので、遭遇する環境変化の多くは、低頻度または初めて経験するものであろう。有限のゲノムサイズで、変化する環境すべてに対して特異的なセンサーやシグナル伝達機構(註5)をあらかじめ備えておくことは難しい。しかし粘菌と大腸菌は、初めての出会いにも関わらず、お互い柔軟に適応できた。それではシグナル伝達機構が用意されていない環境変化に対して、細胞はどのように応答するのであろうか?
この質問に答えるために次のようなモデルシステムを作った。二重抑制制御ネットワークである。大腸菌のゲノムには「オペロン」という単位があり、その中の遺伝子はすべて一緒に発現する(図3)。
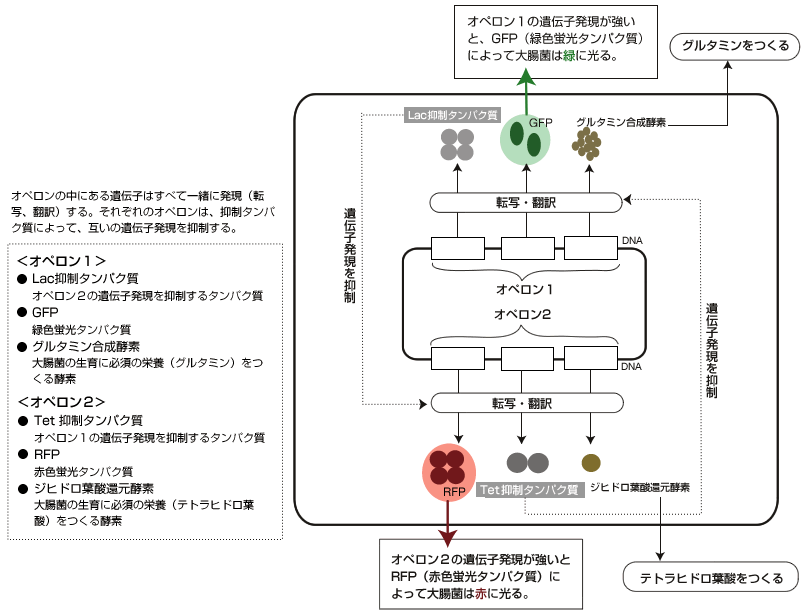
(図3) 二重抑制制御ネットワークを持つ大腸菌
オペロンの中にある遺伝子はすべて一緒に発現(転写、翻訳)する。それぞれのオペロンは、抑制タンパク質によって、互いの遺伝子発現を抑制する。
ここでまず、2つのオペロンを作り、それぞれオペロンには互いのはたらきを抑制するタンパク質をつくる遺伝子を入れた。さらに、大腸菌の生育に必須の栄養分(グルタミン、テトラヒドロ葉酸)をつくる酵素の遺伝子、各オペロンの遺伝子発現量を蛍光の強さで測定する遺伝子も組み込んだ。実験としては、オペロン1とオペロン2をもつプラスミド(註6)を作り、それを持つ大腸菌を培養した。
ここで起きることを考えてみよう。オペロン1の遺伝子発現が少しだけゆらぎで強まると、そこにコードされている抑制タンパク質も増えて、オペロン2の遺伝子発現を抑制する。その結果、オペロン2の遺伝子発現が弱まり、オペロン1を抑制できなくなるため、オペロン1はさらに強く発現する。この逆の反応も当然起こりうるため、最終的に大腸菌は、どちらか一方のオペロンだけを発現した2つの安定な状態(アトラクター)になる。よって、単一遺伝型をもった大腸菌が、同じ環境でも2つの異なる表現型(赤色蛍光と緑色蛍光)を確率的に示すことになる。
そこで、グルタミンやテトラヒドロ葉酸が欠乏した環境に大腸菌を移してみた。グルタミン欠乏環境に移すと、ほぼすべての細胞はその栄養を補うオペロン1を選択的に発現して緑色になり、その後再び増殖を始めた。テトラヒドロ葉酸欠乏環境では、その逆で、オペロン2が発現し、細胞は赤くなる。この現象は、偶然片方のオペロンを発現した一部の細胞が増えたのでもなければ、ゲノムのほかの領域にコードされている未知のシグナル伝達機構が働いたわけでもない。シグナル伝達機構が存在しない環境変化に対して、それぞれの細胞が遺伝子ネットワークを適応的に変化させる臨機応変さには驚くほかない(引用-3)。
(註5) シグナル伝達機構
さまざまなタンパク質によって細胞内もしくは細胞間で信号を伝達するしくみ。この信号伝達によって細胞の機能を制御できる。
(註6) プラスミド
細菌の染色体とは独立して増殖できるDNA。
4.ゆらぎを利用した窮地からの脱出
こうなると、二重抑制制御ネットワークで、外部環境に適応できるオペロンだけを発現したしくみを知りたくなる。実験と理論考察より、アトラクター選択という仕組みを考えている(図4)。
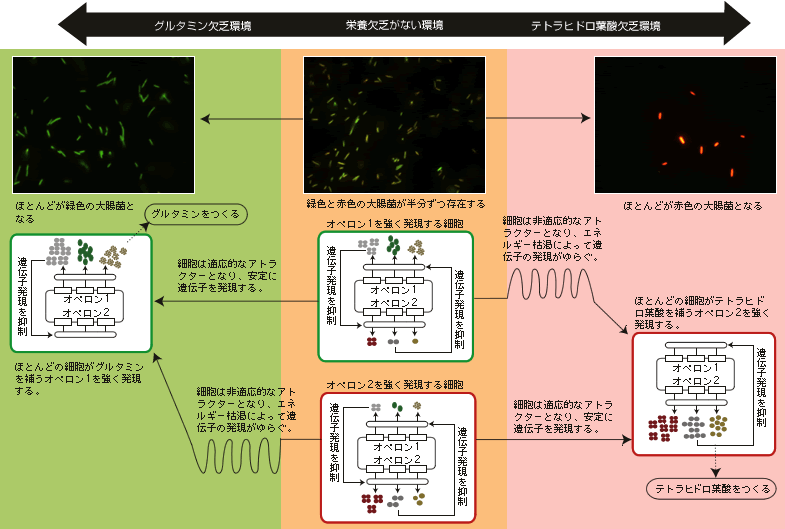
(図4) 環境に応じて遺伝子発現を変化させる大腸菌
大腸菌は外部環境に応じて、選択的にオペロンを発現することができる。栄養欠乏がない環境では、オペロン1を発現する細胞(緑色)、オペロン2を発現する細胞(赤色)が半分ずつ存在するが、グルタミンやテトラヒドロ葉酸欠乏環境では、半分の細胞は栄養を補えない非適応的なアトラクターとなり、エネルギー枯渇によって、遺伝子発現にゆらぎが生じる。そのゆらぎを利用して、細胞は栄養欠乏の補える遺伝子発現の状態を偶然にとることができ、安定した状態を保つことができる。
このネットワークでは、どちらか1つのオペロンの発現が強くなり、もう1つが抑制された安定状態(アトラクター)が2つある。だから、環境変化によってある栄養欠乏になっても、半分の細胞はその欠乏を補うことができる適応的なアトラクター(栄養欠乏を補う遺伝子を強く発現する状態)へ向かい、残りの半分の細胞はもう1つのアトラクター、つまり栄養欠乏を補う遺伝子が抑制される方へ向かうということが確率的に起こる。後者の場合、生きるために必要な生体高分子がつくれないので、代謝反応が進まず、エネルギーの枯渇を引きおこし、増殖できない。つまり外部環境に適応できないアトラクター(非適応的アトラクター)となるのだ。
このような非適応的なアトラクターがこのままであれば「死」しかないのだが、前述した遺伝子発現のゆらぎという細胞の柔軟性が、この窮地から救い出す。非適応的なアトラクターでは、エネルギーが枯渇しているので抑制タンパク質をつくることができず、二重抑制制御ネットワークの遺伝子発現制御が弱くなる。制御が弱くなったために、遺伝子発現がより大きくゆらぎ出す。このゆらぎによって、細胞は非適応的なアトラクターから離れて、偶然適応的なアトラクターへ近づく。そうなると栄養欠乏が補われるので、再び二重抑制ネットワークの遺伝子発現制御が強くなり、適応的なアトラクターに到達して、そこに留まるのである。実際、時間がたてば、残りの半分の細胞のほとんどが非適応的なアトラクターから離れて、適応的なアトラクターへ到達する。細胞のエネルギーが枯渇すると遺伝子発現制御がうまくできず、遺伝子発現量をふらつかせる。その中で、たまたま外部環境に適応できる発現量になると、遺伝子発現制御が復旧し、その状態を安定に維持できる。つまり、ゆらぎがあるがゆえに、エネルギー枯渇という危機が、細胞を危機から救い出す引き金になるという興味深い現象が起きるのである。
5.無駄が多いからこそ続く生きもの
現在、細胞内ゲノムネットワークの環境応答としてよく知られているのは、タンパク質による環境変化の感知とシグナル分子によるプロモーター領域(註7)への情報伝達である。これらは、長い進化の中で獲得されてきた精緻な分子機構であり、過去に同じ環境変化が何度も起こり、より効率のよいしくみを持つ細胞が選択されてきたのである。だからこの機構はよく見られる環境変化には効率よく働くが、予期せぬ環境変化には対応しにくい。人工知能を備えた機械が過去に学習した外部変化にはよく応答するが、学習していない外部変化には応答しにくいのと同じである。ここで紹介したアトラクター選択による環境応答は、ゆらぎを機動力にしているので効率は悪いが、特別な分子機構を必要としていないので、広範囲の環境変化に適応できる。
長い進化の過程で、ある環境変化に効率的に適応し、より個体数を増やして勝ち残ってきた生物がいるはずである。しかし、あまり効率化をすると、無駄な動きが減って、揺らぎが小さくなる。分子進化実験で、ある遺伝子の効率が最も良くなるように改変すると、ゆらぎが減ることも確認している。遺伝子代謝ネットワークはゆらぎが減って柔軟性を失うと、環境変化に柔軟に対応しにくくなる。上で紹介した2つの実験でもゆらぎによる柔軟性があるからこそ予期せぬ環境に適応できたのである。長い歴史の中で生き残ってきた生きものは、柔軟性を残して、環境にしなやかに適応してきたと考えてよいだろう。しかし効率化によって他の近縁種との競争に勝ち残った結果、柔軟性を失い、環境変化によって滅んでしまった種も少なくないのではないだろうか。実際、周りを見た時、あまり効率的とは思えない生きものが見られるが、このように考えるとそれもうなずける。アメーバのように環境によって大きくなったり、小さくなったりしながら、うろうろするのは、まさに生きものらしい生き方であり、そのような生き方は楽しいのかもしれない。
(註7) プロモーター領域
転写開始に関与するDNA側の領域を指す。プロモーター領域にRNAポリメラーゼIIを始めとするさまざまなタンパク質が相互作用することで、転写が開始する。
引用文献
1. Todoriki M, Oki S, Matsuyama S, Ko-Mitamura EP, Urabe I, Yomo T. (2002)An observation of the initial stage towards a symbiotic relationship. Biosystems. Mar-May;65(2-3):105-12.
2. Matsuyama S, Furusawa C, Todoriki M, Urabe I, Yomo T. (2004) Global change in Escherichia coli gene expression in initial stage of symbiosis with Dictyostelium cells. Biosystems. Mar;73(3):163-71.
3. Kashiwagi A, Urabe I, Kaneko K, Yomo T. Adaptive response of a gene network to environmental changes by fitness-induced attractor selection.(2006) PLoS ONE. Dec 20;1:e49.
四方哲也(よも てつや)
1991年大阪大学大学院工学研究科博士後期課程修了、工学博士。
同助手、同助教授、大学院情報科学研究科助教授を経て2006年より同教授。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)