顧問の西川伸一を中心に館員が、今進化研究がどのようにおこなわれているかを紹介していきます。進化研究とは何をすることなのか? 歴史的背景も含めお話しします。
バックナンバー
軟骨魚から硬骨魚の進化
2014年12月15日
進化の過程では、新しい構造、機能、臓器、細胞の獲得、あるいは喪失が繰り返され、多様な生物が生まれてきた。次世代シークエンサーが気軽に使えるようになってから、地球上に現存している様々な生物のゲノムが相次いで解読され、生物多様性の根拠をはっきりとゲノムの配列の違いとして語ることが可能になった。では、ゲノムは動物の体の構造や機能の違いについて何を語ってくれるのだろうか? この問題を考えるため、これから何回かにわけて脊椎動物のゲノム研究に焦点を絞り、最近の研究がこれにどう答えようとしているかを見ていきたい。今回は現存するもっとも原始的なサメのゲノム解読についての論文を紹介する。タイトルは「Elephant shark genome provides unique insights into gnathostome evolution(ゾウギンザメのゲノムは顎口類の進化にユニークな洞察を与えてくれる)」だ。
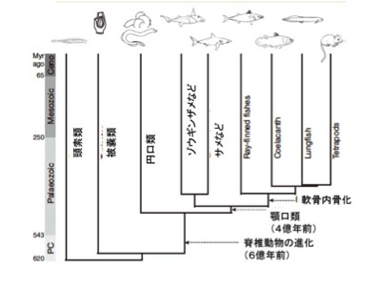
図1:ゾウギンザメ(全頭亜綱ギンザメ目)の系統樹。紹介している論文の図1を改変(Nature,505,175)
図1に示すように、脊椎動物はまず脊索動物と呼ばれるホヤの仲間から分かれる。ただ最も原始的段階の脊椎動物は円口類と呼ばれ、ここから軟骨魚、そして最後に硬骨魚が進化してくる。これらの種についてのゲノム研究が目指すのは、新しい構造や機能獲得と対応するゲノムの変化を特定することだが、通常形質とゲノムの関係は極めて複雑で一筋縄ではいかないことが多い。しかし時には期待以上にわかりやすい対応関係が見えることもある。この論文はそういった例の一つで、もちろん論文を読む私たちにも内容はわかりやすい。研究には日本も含む多くの研究室が参加しているが、責任著者から見るとシンガポールのAスターとワシントン大学の共同研究で今年1月のNature誌に掲載された。嬉しいことにこの論文はオープンアクセスで別刷りもウェッブから手に入り、クリエーティブコモンズとして扱えることを明記しているので、論文の図などもこのサイトにも掲載できる。

図2:ゾウギンザメのイラスト(Wikiより)
研究では、最も原始的な軟骨魚類、ゾウギンザメ(図2)のゲノムを解読して、すでに解明が終わっている硬骨魚類のゲノムと比較することで、軟骨魚類に存在せず硬骨魚類に存在する2つの形質の獲得過程の背景にあるゲノム変化を特定しようと試みている。
内軟骨骨化
まず軟骨魚と硬骨魚を分ける最も重要な性質、骨の形成だ。サメ肌と呼ばれるように、サメの皮膚や軟骨に石灰沈着はあるが、時には獰猛で人も襲うサメに骨がないと聞くと驚くかもしれない。しかし、サメは骨化した内骨格(サメの場合例えば背骨)を持つことはない。一方硬骨魚では、まず軟骨により骨格が形成され、その軟骨でできた骨格を軟骨内骨化によりカルシウムの蓄積した骨に変える。この変化に対応する新しい遺伝子の特定がこの研究の一つの目的だ。カルシウム代謝に狙いをつけ、それに関わる遺伝子を比べていくと、分泌性カルシウム結合リン酸化タンパク(SCPP)がゾウギンザメにはない。遺伝子配列の比較から、SCPPは脊索動物の生まれた時から存在する分泌型リン酸化タンパク(Sparc)が重複しSparc like1(Sparcl1)ができた後、さらに重複を繰り返して生まれてきたファミリー分子だ。
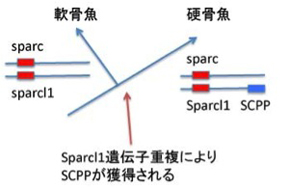
図3:軟骨魚と硬骨魚の分化に伴う、分泌性カルシウム結合リン酸化タンパクの遺伝子重複による獲得。
図3に示すようにゾウギンザメゲノムにはSparc, Sparcl1は存在しているが、SCPPは存在していない。ところが硬骨魚になると、Sparc1に近接してSCPP遺伝子が新たに加わったクラスターができている。これまでの研究でSCPP遺伝子は骨と歯の骨化を調節していることが明らかになっている。これらの結果から、軟骨内でカルシウムと結合し沈着させるSCPP遺伝子が遺伝子重複により新たに獲得されることにより、軟骨内骨化が可能になったというシナリオが考えられる。これを確かめるために、この研究ではゼブラフィッシュのSCPP遺伝子をCRISPR/Cas9と呼ばれる遺伝子編集酵素(詳しくは第9話参照→)を使って働かなくしている。すると予想通り、硬骨魚であるゼブラフィッシュの骨化が強く抑制された。軟骨が骨化するかどうかという違いだけに絞ってみれば、予想したシナリオどおり、進化過程で新しいSCPP遺伝子が生まれたことが硬い骨を持つ硬骨魚進化の鍵となる出来事であることがわかる。この話はしかし、期待通りの結果が得られた典型と言って研究だ。
CD4T細胞
ゾウギンザメのゲノムが与えたインパクトの中で最大のものは、CD4と呼ばれる分子が欠損していたことだ。もちろん進化では新しい分子の獲得もあるが、遺伝子の欠失はもっと普通に見られる。ただよく調べていくとゾウギンザメのCD4は欠失ではなかった。というのも、ゾウギンザメのゲノムを調べるとCD4T細胞の30年にもわたる研究が明らかにしてきた遺伝子群がそっくりなくなっていることがわかったからだ。この驚きを共有してもらうためには、脊髄動物のT細胞のことを少しは知っておく必要がある。論文に掲載されていた図(図4)を参考にしながら手短に説明しよう。
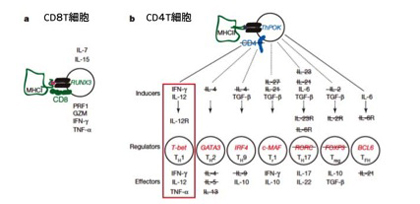
図4:CD4T細胞の進化 紹介している論文(Nature,505,175)の図5を転載。哺乳動物では、CD8T細胞はクラス1抗原と呼ばれる組織適合性抗原分子に提示されたペプチドを認識して相手の細胞を障害する。一方CD4T細胞は様々な免疫反応を助けるヘルパー機能を担っており、さらに様々な(ここでは7種類)のサブセットに別れる。エイズはこの細胞が減ることが症状の原因となっているが、免疫不全の症状からCD4T細胞の重要性がわかる。円はそれぞれの細胞を示し、中には分化を決定している転写因子を記載している。CD4T細胞の分化にはそれを誘導するサイトカインが必要でinducerとして示されている。それぞれのサブセットは異なるサイトカインを分泌し、この図ではeffectorsとして示されている。バーが引かれた分子は全てゾウギンザメには存在しない。この結果から、ゾウギンザメではTh1細胞に対応するヘルパーT細胞は存在するが、それ以外のサブセットは存在していないと想像される。
T細胞は胸腺で分化するリンパ球で、出来立てのT細胞はCD4、CD8の表面分子で2種類に分けることができる。CD4T細胞はヘルパーT細胞と呼ばれ免疫調節の中心になっている。一方CD8T細胞はキラーT細胞と呼ばれ、自己以外の細胞を障害して殺す役割を担っている(ゾウギンザメゲノムにはCD8は存在し、胸腺にもCD8T細胞は存在する)。CD4T細胞は様々な刺激に応じてさらに機能の異なるグループに分化する。この論文では7種類(Th1, Th2, Th9, Tγ1,Th17,Treg, Tfh)に分かれるとする考えを採用して図に示している。この分化についてはマウスで最も研究が進んでおり、それぞれは異なる刺激により別々の転写因子(赤字)を発現し、異なる機能を持った細胞に分化する。主な機能の違いは抗原刺激によって誘導されるこれらのエフェクター分子の違いによる。エイズはこの細胞がウイルスに感染して消失する病気だ。免疫が低下し、感染にかかりやすくなるというエイズの症状を見ると、CD4T細胞の重要性をわかってもらえると思う。さて詳しい免疫学の講義は全て割愛するが、この図自体が1984年にCD4T細胞が定義されてからの30年にわたるCD4T細胞研究の結晶だ。それが全て硬骨魚と軟骨魚の差として浮かび上がってきたのを見ると、進化の偉大さに圧倒される。
さて、この図に示されている結論だけをまとめると次のようになる。現存の最も原始的な顎口類ゾウギンザメにはすでにT細胞分化に必要な分子は備わっており、また我々の持つのとほぼ同じCD8キラーT細胞を分化させる仕組みも発達している。次回に述べるが、これらの免疫に関わる遺伝子群は全て顎口類が4億年前円口類から分離した後に獲得されてきた。しかし、ゾウギンザメではCD4Tヘルパー細胞分化に必須の転写因子、ThPOK,T-betは備わっていても、肝心のCD4遺伝子が存在しない。このため、ヘルパー機能を持つT細胞は存在するが、CD4を使う段階には至っていないと言える。また、刺激因子やエフェクター分子遺伝子から見て、ゾウギンザメに存在するヘルパー細胞はいわゆるTh1ヘルパー細胞だけで、ヘルパー機能の複雑化は顎口類が発生してから徐々に起こったと考えられる。一つの鍵になる遺伝子に収束した軟骨の骨化と比べると、CD4T細胞系統の進化はスタートラインが見えたところだ。今後、他の軟骨魚や硬骨魚のゲノムを丹念に調べることで、まずヘルパーT細胞がCD4を獲得してCD4陽性ヘルパーT細胞になり、次にエフェクター分子を開発したり借りてきたりすることで、一挙に多様な機能を獲得していく過程がつなぎ合わされるのではと期待する。しかし、この進化の順序がCD4T細胞についての免疫学研究の歴史的順序と同じなのは偶然の一致とは言え、感慨が深い。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)