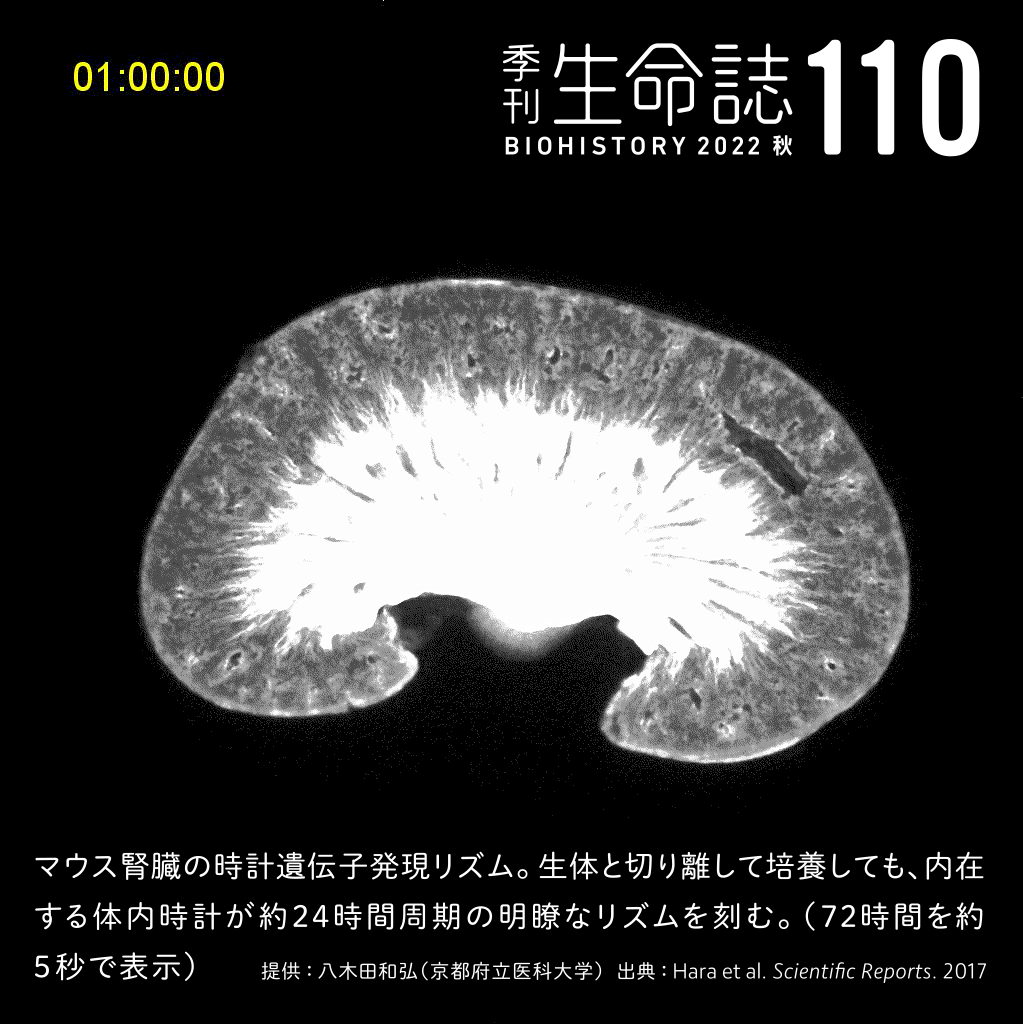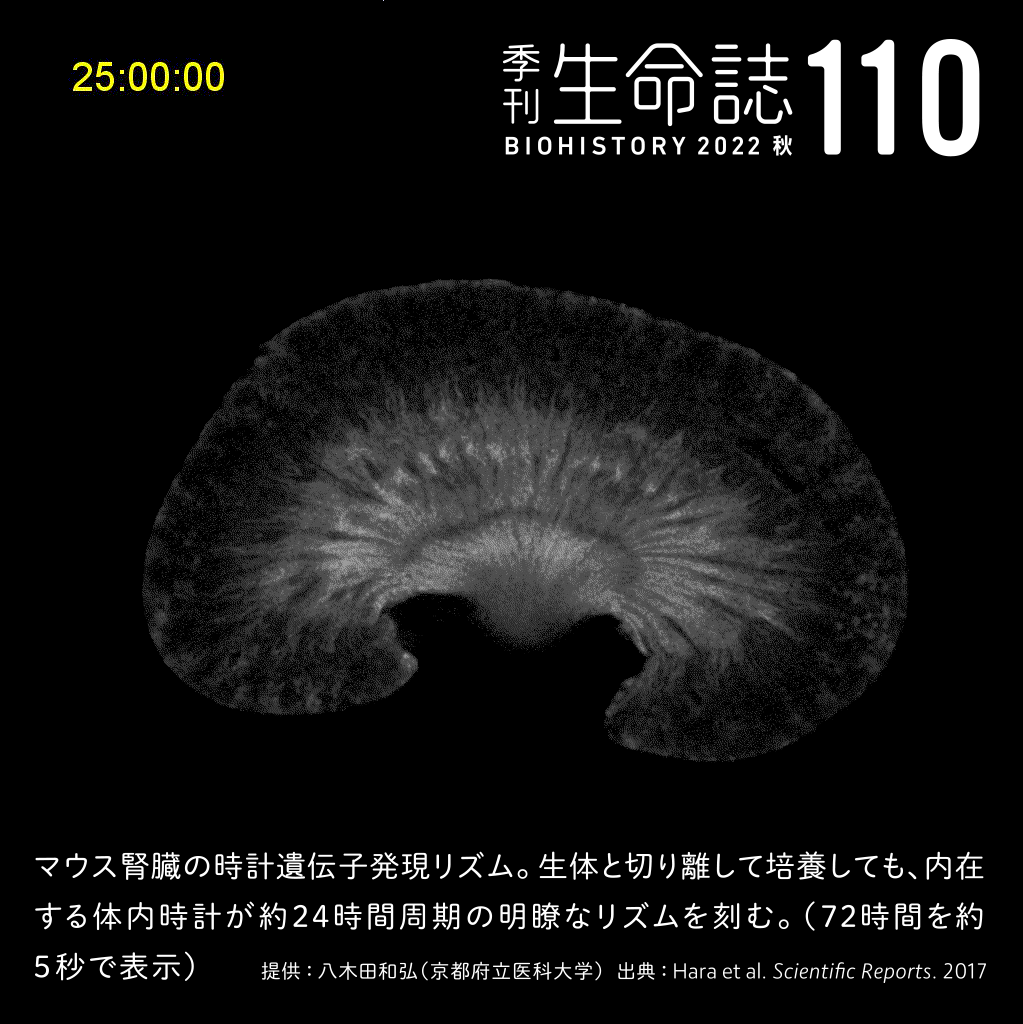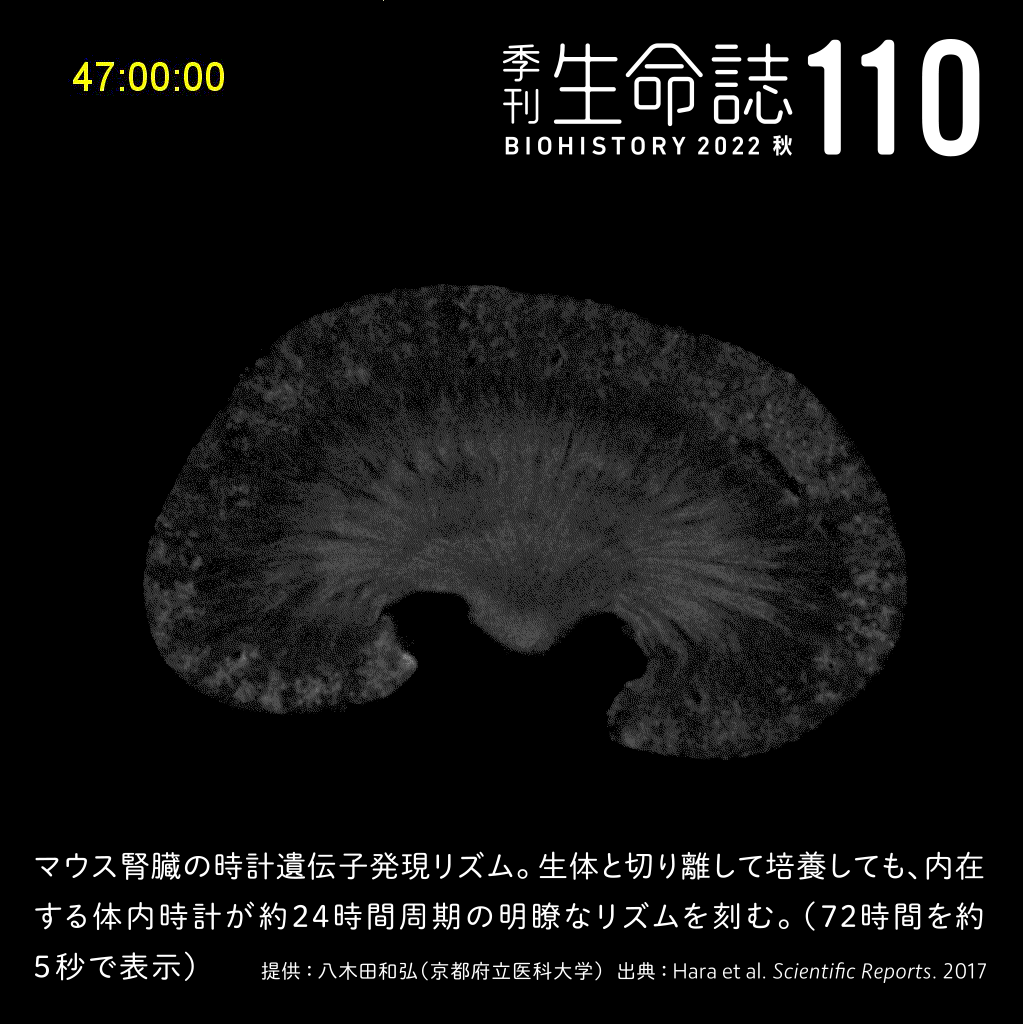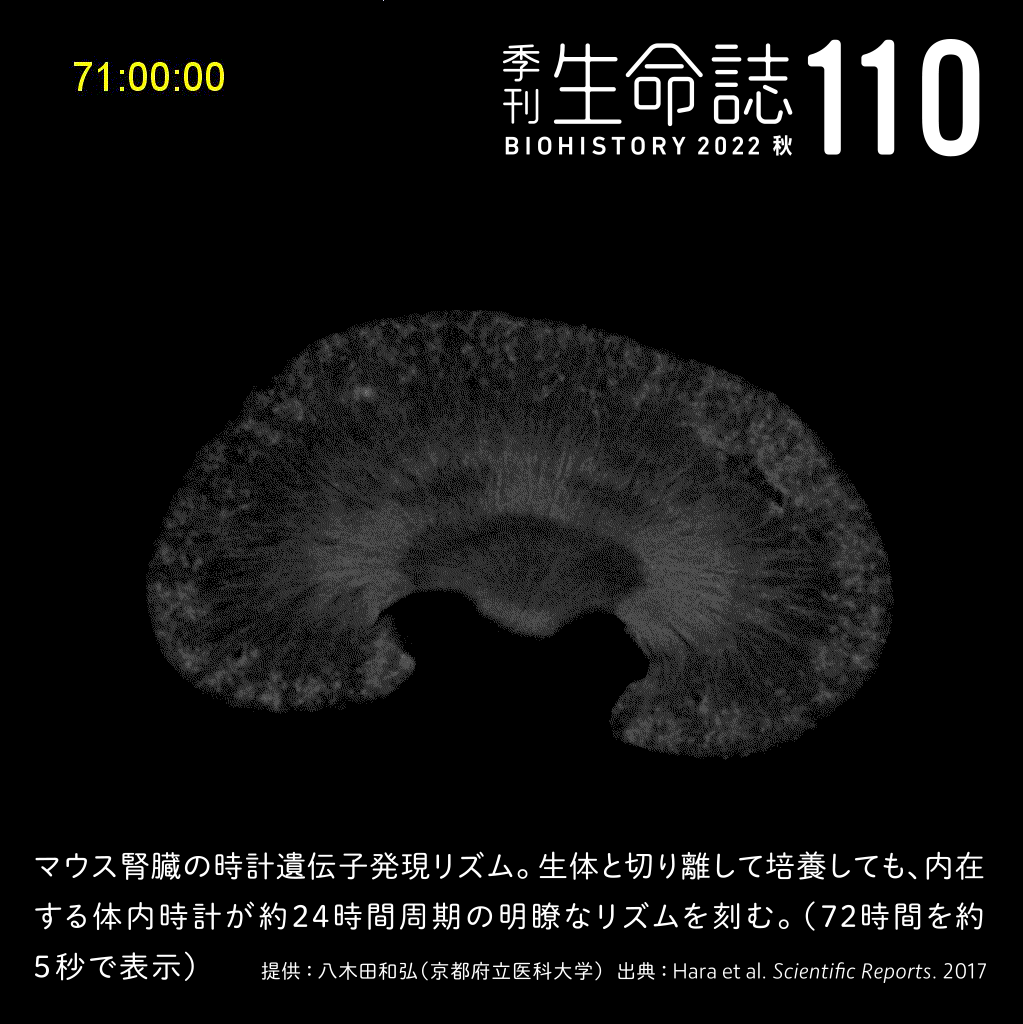
Experiment
ミクロの世界の擬態
緻密で複雑な反応が行なわれている細胞の中。そこには擬態までもが存在し,RNAをまねたタンパク質が驚くほどの正確さで遺伝暗号を読み取っている。
しかし,どうやって・・・?
—32年間,解き明かされなかった問いへの答は,RNAからタンパク質への進化の過程を見せてくれるかもしれない。
そんなことはすべてわかっている。教科書にも載っているじゃないかと思われているのに,じつは大事なところが抜けており,それを調べたらとんでもなく面白いことがわかってくる。こんなことが研究の世界では少なくない。
DNAの塩基配列ATGCとして存在する遺伝情報を,実際の酵素や筋肉として働くタンパク質に翻訳する方法は,分子生物学の最初の質問の一つだった。したがって,分子生物学が本格的に始まった1960年代から70年代初めにかけて,その研究が精力的に行なわれ,DNAの遺伝情報を写し取ったメッセンジャーRNA(mRNA)がリボソームにいってタンパク質に翻訳されるという過程が見事に解明された。
ここで活躍するのが,トランスファーRNA(tRNA)で,逆L字型をした端にmRNAと対になる塩基配列をもち,mRNAとタンパク質の間を取りもっている(図1)。図を見るとわかるように,tRNAは一端でmRNAの塩基の並びを3文字1セット(コドン)として認識し,もう一端はコドンが指定するアミノ酸をつけている。コドンを認識するtRNA側の塩基配列をアンチコドンと呼ぶ。こうしてmRNAの塩基配列に対応するアミノ酸の並んだタンパク質ができあがるわけだ。

タンパク質の合成過程
遺伝情報は核にある二重らせん構造のDNAに塩基配列ATGCとして存在する。二重らせんがほどけ,一方の鎖を鋳型として相補的な塩基配列をもつ伝令RNA(mRNA)がつくられる(転写)。核外へと出たmRNAにリボソームが結合する。細胞質中の運搬RNA(tRNA)は対応するアミノ酸と結合して,アミノ酸をリボソームヘと運ぶ。mRNA上の塩基配列3文字(コドン)と相補的な塩基配列(アンチコドン)をもつtRNAがリボソーム上でmRNAと結合する。リボソームにはtRNAが結合する部分が2カ所あり,運ばれてきたアミノ酸はここで隣りのアミノ酸と結合し,tRNAから離れる(翻訳)。20種類のアミノ酸が鎖状につながり,それが立体的に折り畳まれて,働けるタンパク質となる。
コドンは塩基3文字からなるので,64通りあり,そのうちの61はアミノ酸を指定し,3つは停止信号(終止コドン)になっている。終止コドンはUAG/UGA/UAAだ。ここへきたら,アミノ酸をこれ以上つなげないこと,つまりタンパク合成は終わりという合図である。ところで,この終止コドンはどうやって読むのか。68年に,反応を終わらせるのはペプチド解離因子(RF1とRF2の2つが発見された)というタンパク質であることがわかったが,tRNAのようにアンチコドンのないタンパク質がどうやってmRNAの終止コドンを読み取るのかはすぐにはわからなかった。この生命現象のもっとも基本に関わる謎は32年もの間そのままにされてきたのである。

コドン表
mRNAの塩基の種類はAGCUの4種類である。4種類の塩基で20種類のアミノ酸を指定するには3文字が必要である(4×4×4=64通り/2文字だと4×4=16通りで,指定することができない)。コドン64通りのうち61通りはアミノ酸を指定し,3通りは翻訳終結を指定する。アミノ酸には水を嫌う疎水性と水を好む親水性のものがある。
われわれは解離因子のアミノ酸配列が何らかの方法でUAG/UGA/UAAという配列を読み取るのではないかという仮説をたてて実験を始めた。というのも,翻訳という作業に関係する翻訳因子と呼ばれるタンパク質の構造が逆L字型をしておりtRNAにそっくりだという最初の報告があったからだ。この形に意味のないはずはない。
詳細は省くが,一般には終わったとみられているテーマに取り組み,しかも相手はなかなか手強かったので,正直結果が出るまでは長かった。5年間の実験の結果,仮説を証明し,『Nature』(2000.2.10)に発表したばかりだ。
わかってみればシンプルな仕組みである(シンプルだからこそ面白い)。終止コドンのうちUGA/UAAを認識する解離因子RF2のほうを例にとると,その中にあるSer-Pro-Phe(セリン-プロリン-フェニルアラニン/ペプチドアンチコドンと命名)というアミノ酸の1番目と3番目がコドンの2文字目と3文字目を読み取っている。親水性で小さいアミノ酸セリンはGでもAでも読み取ることができ,疎水性で大きいアミノ酸フェニルアラニンはAだけを認識する。原理がわかったのでここで働くアミノ酸の一部を変えてみた。Ser-Pro-Thr(スレオニン:セリンと同じく親水性で小さい)にしたところ,予想通り,終止コドン3つに加えてUGGという本来トリプトファンのコドンで,まだタンパク合成が続くはずの場所でも翻訳を終わった。さらに,Pro-Pro-Pheにしたら3つの終止コドンのうちのUAAでしか終わらなくなった。この読み分けはとても正確で100万回に1回しか間違わない。このような働きをする解離因子はおそらく,逆L字型をしておりtRNAそっくりに違いないと考えている。

終止コドンを読み取るペプチド・アンチコドン
RF1はUAA・UAGコドンを,RF2はUAA・UGAコドンを停止信号として読み取る。RF1とRF2のトリペプチド(3つのアミノ酸)の部分が正確に読み分けをしている。比較的小さく親水性のアミノ酸であるセリン(Ser)やスレオニン(Thr)はグアニン(G)とアデニン(A)の両方を認識し,大きめな疎水性のアミノ酸であるプロリン(Pro)やフェニルアラニン(Phe)はアデニン(A)しか認識しない。また,アミノ酸を交換することで読み方を変換できる。
動植物の世界でも擬態は不思議な魅力があり多くの関心を呼んでいるが,分子の世界にも擬態があるとは。生き物はだまし合いを上手に使いながら生きているのかもしれない。しかも「分子擬態」は形だけでなく働きまでもきちんとまねていることが明らかになったのだから,フィギュアスケートだったら,オリンピックで芸術点も技術点も満点を取ったようなものだ。

tRNAと共にリボソーム上で働く翻訳因子
しかも「分子擬態」はそれ以上の意味をもっている。生命体がこの世に登場した時にはRNAワールドを形成し,今はDNAとRNAが担っている情報と,タンパク質が担っている酵素機能など実働部分との両方をRNAがつとめていたと考えられている。最初からDNAとタンパク質がうまく噛み合うようなシステムができたとは考えにくいので,これは妥当な見方であろう。進化の過程でより正確により効率的に反応を進められるよう,DNAとRNAとタンパク質の役割が現在のような形に分かれてきたのだが,「分子擬態」はその間の移行の姿を握る重要な鍵となるに違いない。ここからまた新しい世界が開けそうだ。

tRNAに擬態するさまざまなタンパク質の構造
赤は酸素原子,緑は炭素原子,青は窒素原子,黄色は燐か硫黄原子。
a)フェニルアラニンtRNA(酵母)。
b)リボソームを再生利用する際に必要な翻訳因子(RRFタンパク質/バクテリア・Thermotoga maritima )。
c)実際にtRNAがリボソーム上で働くには,EF-Tuと結合しなければならない。
EF-TuとtRNAの複合体(EF-TU/GTP/フェニルアラニンtRNA/バクテリア・Thermus aquaticus )。
d)伸長因子反応を続けるために必要な伸長因子(EF-G/GDP複合体/バクテリア・Thermus thermophilus )。
(なかむら・よしかず/東京大学医科学研究所助教授)
※所属などはすべて季刊「生命誌」掲載当時の情報です。![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)