一流を夢見て
徳島の田舎で育ちました。父は後継ぎ問題の揉め事に嫌気がさし、生家を飛び出して職業軍人になったそうです。終戦の一年前にオーストラリアの上空で乗務していた爆撃機が米軍機に撃たれて負傷しましたが、幸いその療養中に終戦となり、徳島へ帰ってくることができました。戦後間もなくは生きていくのに精一杯の時代でしたので、帰還後は農業を始めました。非常に勤勉家で論理的に考える人でしたから、一定面積から上質の米をたくさん収穫する方法を試行錯誤で工夫し、近隣の人たちにも教えていましたね。父母の親戚の多くが校長先生や教頭先生という家だったので教育熱心でした。しかし、兄に厳しくしたのを反省したのか、私はかなり自由にさせてくれました。
子どもの頃は野山を駆け巡る普通の男の子でしたが、本を読むのは好きでした。週に一度やって来る移動図書館で、毎回5〜10冊程借りていましたね。小学校から中学校までは『アラビアンナイト』や『グリム童話』など欧米の物語集や日本の歴史ものを好んで読みました。中学の先生をしていた従兄弟が読書家だったので、本をたくさん借りて読み漁っていました。高等学校の終わりから大学にかけては評論家の小林秀雄小林秀雄(1902-1983)文芸評論家。自我の解析を軸とした創造的批判の確立者。『様々なる意匠』『無常といふ事』『本居宣長』など。文化勲章。が特に好きでした。今でも疲れたときや落ち込んだときに、小林秀雄の著書を読むと落ち着きますね。実は大学時代は、小説を書いて友人と回し読みしたり、短歌を詠んだりしていたんです。でも小林秀雄の文章と出会ってから、その切れ味の鋭さに「敵わないな」と思って、文系への進学はきっぱりと諦めたのです。細胞生物学者で歌人の永田和宏さんとは親しく、よく文学の話をするので、私が大学時代に雑誌『群像』を毎月読んでいたと話したら、科学者にはその雑誌を知っている人はほとんど居ませんよと言われました。今でも、中原中也や吉行淳之介など美しい詩・文章を読むことが好きです。絵も好きだったので、中学では美術部に入り、風景画や阿波踊りの絵などを描きました。でも絵も、文部大臣賞を取るような優れた友人が同級生にいたので、これも太刀打ちできないなと思い、美術の道も諦めました。まあ落ちこぼれではありませんけれど才気煥発とはほど遠い子供でしたね。ただ、どの分野でもよいけれど、いつか一流になりたいと思って過ごした少年期でした。

生まれてすぐに母と。徳島の自然豊かな田舎で育ったが生きものに対しての興味はあまりなかった。
近所の秋祭りにて。(本人:左から2番目)

中学生のとき。
タンパク質と向き合いたい
大学への進学にあたっては、文系では食べられないと考え、理系にしました。地元の徳島大学には理学部がないので、医学部栄養学科という日本初の新しい学科に入りました。当時の徳島大学の学長が食物が日本の発展の基盤になるだろうと考えて、栄養学科を創ったのです。入学後、生命研究の基礎に興味を持ったのですが、間もなく学生紛争が始まってしまいました。学生運動には、あまり積極的ではありませんでしたが友人に誘われて参加しましたし、東京大学の安田講堂攻防戦は東京見物を兼ねて見に行きましたよ。1年間以上授業がありませんでしたから、その間に色々な遊びに興じてしまったというのが正直なところです。大学再開後、進路について悩んでいる時に、医学部栄養学科と連携講座となっていた医学部附属酵素研究施設に、市原明(徳島大学名誉教授)という三十代の若い教授が就任されたのです。その頃、酵素学で日本の先頭を切っていた大阪帝国大学生化学教室の初代教授はトリプトファンの中間代謝研究で著名な古武弥四郎先生、その後を引き継がれたのが、市原明先生の父上の市原硬先生でした。市原先生に教えを乞い、修士課程では、トランスアミナーゼの代謝経路の研究をしました。まだ将来研究者になるかどうかは決めていませんでしたが、この研究をもう少し突き詰めたいと考えて博士課程に進むことにしました。ところが市原先生が、「博士課程に進むのはいいけれど、もうアミノ酸代謝じゃ食っていけないよ」とおっしゃるのですよ。かと言って、やるべき研究課題を具体的に提案してはくれません。研究テーマを自分で一生懸命考えるほかない状態におかれたわけです。辛かったけれど自由を与えられたわけで、その後を振返ってみると、貴重な経験だったと今思います。貧しかったので、生活費も授業料もアルバイトで稼いでいましたから、日曜日なんて朝昼晩と一日中家庭教師でしたよ。そんな中で研究内容を自分で考えて実験するのですから大変な毎日でしたが、代謝学への興味は続いていました。ちょうど「動的生化学」という概念が登場し、これが面白いと思ったので、タンパク質代謝に向き合おうと決めました。
徳島大学栄養学科のクラスの人と阿波踊り大会にて。学科毎に学生による踊りの連がある。(本人:前列右から6番目)

1975年頃、大学院時代に市原明先生と。ドイツで開催された国際生化学学会に出席。
酵素研のメンバーと愛媛県の石鎚山にて。この頃はよく山登りをしていた。(本人:左から3番目)
タンパク質の分解機構への問い
酵素研究施設に移った1973年頃、生物学の世界はセントラルドグマセントラルドグマ核酸やタンパク質の合成過程で遺伝情報の流れは一方向的であり、いったんDNAの情報が読まれ、タンパク質に変換されると、そこから逆戻りをして、再度核酸の塩基配列を構築することはない、という生物則のこと。を中心とした分子生物学に沸いていました。1953年のワトソン・クリックのDNA二重らせん構造の発見以来、タンパク質合成の研究が生命科学の主流でした。mRNAやtRNAあるいはリボゾームの研究が世界的に流行した時代であり、優秀な友人たちの多くはそちらに進んで行きました。ところが私は、合成されたタンパク質がその後どういう運命を辿るのかに興味を持ったのです。当時、既に数百種類の加水分解酵素を持つリソソームという細胞小器官が知られており、リソソームが全てのタンパク質を処理しているという見方が主流でした。今流行のオートファジーオートファジーオートファジー
細胞が自己の一部(例えばミトコンドリアや小胞体)を取り囲む膜をつくり、さまざまな加水分解酵素をもつリソソームが中心となって消化すること。
参考:
季刊生命誌45号リサーチ
オートファジーの現場をとらえる-細胞が自分を食べる理由-
東京都臨床医学総合研究所 水島昇
季刊生命誌62号サイエンティスト・ライブラリー
自分を食べて生き残る細胞に魅せられて 大隅良典という現象は、実はこのリソソームの発見直後の1960年頃に観察されていたのですが、当時はあまり注目されませんでした。

私にはタンパク質について気になることが2つあったのです。1つはタンパク質の寿命が不均一であることです。その頃、放射性アミノ酸を使った研究で、タンパク質には寿命があることが分かり始めました。研究が進むと、タンパク質の寿命は千差万別で、数分から数カ月まで、約一万倍もの開きがあることが分かったのです。もちろん、DNAには寿命の情報は書き込まれてはいませんから、タンパク質の寿命を説明する他の暗号(メカニズム)があるとは考えられていたのですが、その実体は不明でした。
もう1つは、栄養学的な収支の問題です。私たちの体は毎日約200グラムのタンパク質を合成しますが、食事から摂取する材料は僅か70グラム程度、残りの130グラムがどこから来るかが大きな疑問でした。後に、分解したタンパク質を再利用していることが判明しますが、このプロセスは当時全く分かっていなかったのです。そこで、ほとんどの人たちがタンパク質合成の解明に向けて研究をする中で、私はタンパク質分解に大きな未知があると思い、そちらに向かったのです。
運命の論文との出会い
タンパク質分解に興味をもつ中で、私の運命を左右する2つの論文に出会いました。1つは1953年にM.V.シンプソンが発表した「生細胞におけるタンパク質分解には代謝エネルギーが必要である」という論文です。タンパク質分解の発展に大きく貢献することになるこの発見は、奇しくもワトソンとクリックがDNA二重らせん構造のモデルを提唱した年に行われました。タンパク質の合成は、化学反応としては簡単明瞭で、20種類のアミノ酸のアミノ基とカルボキシル基の間で水が抜ける脱水縮合反応によって、ペプチド結合が形成されるのです。一方タンパク質の分解は、水分子が加わることによって進む加水分解反応です。そして、この2つの反応には熱力学的に決定的な違いがあります。合成反応はATPのエネルギーを必要とする“吸エルゴン反応”、分解反応はエネルギーを必要としない“発エルゴン反応”です。シンプソンの論文は、この熱力学の法則に反することを言っているわけで、その後約25年間、誰からも顧みられることなく図書館の奥に眠り続けることになったのです。
この独創的・先駆的な研究に光を当てたのが、私の恩師であるハーバード大学のA.L.ゴールドバーグでした。彼は学部生のころから『Nature』に論文が掲載されるような秀才で、30代半ばでハーバード大学の教授になり、筋肉のタンパク質の動態についての研究で著名な業績を挙げていました。当時、大腸菌にはATPを使ってタンパク質を分解する酵素(ATP依存性プロテアーゼ)があることが知られており、ゴールドバーグはこの研究に集中すると同時に、真核生物にも似たような酵素の存在を探っていました。しかし、哺乳動物細胞の抽出液にATPを加えてもタンパク質分解は亢進しません。彼はここで、網状赤血球を用いることを思いつきました。網状赤血球は赤血球に成熟してゆく直前の細胞であり、ヘモグロビンを大量に合成する必要性からタンパク質合成活性が高いのは確かです。しかし一方、最終分化の過程で細胞内小器官を含む細胞質成分の大部分を分解しなければならないので、他の細胞よりタンパク質分解が顕著なはずだと考えたのです。この慧眼がその後のタンパク質分解の研究を大きく変えることになりました。実際、このアイデアは見事に当たり、網状赤血球の抽出液にATPを添加すると、タンパク質の分解が激しく促進されることが見出されました。この結果は1977年の『PNAS』に掲載され、私の運命を決める2つ目の論文になりました。
博士課程2年生の時、助手を勤めていた小川紘一先生が異動され、私が助手として本格的に研究者の道を歩み始めることになりました。恩師の市原先生が分岐鎖アミノ酸の研究でゴールドバーグと旧知の仲でしたので、彼の研究室への留学を決意しました。しかしゴールドバーグは日本人を採用した経験がないこともあり、徳島という知らない土地の名もなき若者など眼中になかったのでしょう。すぐには留学はできませんでした。実はゴールドバーグは、ATP依存性のタンパク質分解酵素の同定が出来ず、当時の研究室には暗雲が立ちこめていたと後で聞きました。

左から本人、親友で研究仲間のC.H.チョン(Chin Ha Chung)教授(現・ソウル大学)、A.L.ゴールドバーグ(Alfred L Goldberg)教授。ハーバード大学医学部前にて。
ユビキチンシステム発見からの逆転

その翌年の1978年、ゴールドバーグには晴天の霹靂ともいうべき衝撃的な論文が発表されました。イスラエルのA.ハーシュコとA.チカノーバーがゴールドバーグの開発した実験系(網状赤血球の抽出液)を用いて、ATP依存性のタンパク質分解因子APF-1(ATP-dependent proteolysis factor 1)を発見したのです。そして1980年には、APF-1がユビキチンユビキチン76個のアミノ酸からなる非常に小さなタンパク質で、進化的保存性が高く、アミノ酸配列は全ての真核生物でほぼ同じである。ユビキチンは単体での機能は有していないと考えられており、他のタンパク質を修飾することで機能を発現する。と同一分子であること、基質タンパク質と鎖状的に共有結合することを明らかにし、ユビキチンが標的タンパク質を分解装置に輸送するための目印となるという“ユビキチンシグナル仮説”を提唱しました。この仮説の白眉となる主張は、ATPのエネルギーはユビキチンの基質タンパク質への修飾(共有結合)反応に使われると説明したことです。これはタンパク質の合成反応と類似した化学反応ですので、エネルギーの要求性を見事に説明できました。これまでのタンパク質分解の概念とは全く異なる考え方であり、ゴールドバーグを含めたエネルギー依存性のタンパク質分解酵素を追っていた研究者たちを驚愕させました。しかし、ゴールドバーグ研究室ではユビキチンによるタンパク質の修飾反応が再現できず、ユビキチン仮説は誤りであると考えていました。
私はというと、1981年にやっとゴールドバーグに受け入れの許可をもらい、希望に燃えながらアメリカへ向かいました。私が研究室入りを許可されたのは、酵素学研究所の出身であり、酵素に関わる実験が得意だろうと見込んでとのことだったようです。そして私に与えられたテーマは何と「ユビキチン仮説が誤りである」ことを証明することでした。私は、ラボにある既存の試薬は一切使わないという条件で実験を行い、3週間ほどで結果を出しました。ハーシュコらの論文に記載された方法を忠実に辿ると、いとも簡単にユビキチンの付加を示す電気泳動写真が綺麗に再現できました。ゴールドバーグは落胆しましたね。ハーシュコらの説が正しかったのですから。ユビキチンのC末端のGly残基が標的タンパク質のLys残基と会合するのですが、ユビキチンを上手に精製しないと細胞質のカルボキシルペプチダーゼによってGly残基が外れ、不活性型になってしまいます。ゴールドバーグ研究室では、友人からもらった不活性型のユビキチンを使っていたため正しい結果が出せなかったのです。実はハーシュコらは熱安定性のユビキチンを効率的に精製するために、熱処理を行っており、これがカルボキシルペプチダーゼを失活させていたのです。不作為の幸運であったともいえます。
実は私は、この実験と併行して別の実験を行っていました。ユビキチンの結合にエネルギーが必要であることはハーシュコらが報告しましたが、果たして全エネルギーがこの過程のみで消費されるのかということを確かめようと考えたのです。実験の結果、すでにエネルギーを使ってユビキチン化したタンパク質の分解にもATPの加水分解、すなわちエネルギーが必要であることがわかりました。それが私の最初の出世論文になった、「エネルギー依存性の2段階説」という新たなタンパク質分解システムの提案でした。1983年のことです。これが、ATP依存性タンパク質分解酵素の発見への糸口になりました。

ノーベル賞受賞後の2005年、A.ハーシュコ(Avram Hershko)に東京で再会した。(本人:右)
20Sプロテアソームの発見
実はこの研究には非常に辛い作業がありました。試料となる網状赤血球採取のため数百羽のウサギを飼育し、月曜日から金曜日まで毎日数羽のウサギの腹腔内に溶血作用のあるフェニルヒドラジンを1mLずつ注入するのです。翌週の月曜日に耳から血液を30mLぐらい取ると、70%ぐらいが網状赤血球になっています。ゴールドバーグ研究室では5年間、延々とこの単純な作業を続けていました。網状赤血球の抽出液のATP依存性分解活性は、1日毎に半減していきますので、2〜3日しか実験ができず、この苦渋に満ちた作業が必須だったのです。このまま2年間も網状赤血球の作製を続けると、留学生活が憂鬱になると思った私は、何とかATP依存性のタンパク質分解活性を安定化したいと考えました。不安定な酵素の安定化にはグリセリンが有効と酵素研時代に学んでいたので、抽出液に20%のグリセリンを添加したところ、驚くべきことに数ヶ月間活性が保たれることがわかりました。研究室のウサギは数十羽に減り、その世話に辟易していた研究室のみんなも喜んでくれました。それからというもの私の評判は鰻登り、高慢なハーバード大学の学生たちの私への接し方が一変し、以後は楽しい留学生活になりましたね。
この結果に驚いたゴールドバーグは、グリセリン効果が他の競争相手に漏れないよう箝口令を敷きました。この現象を詳細に調べてみると、グリセリンがないとATPのタンパク質分解の促進効果は速やかに低下しますが、決して全体の活性が低下しているのではないことがわかりました。ATPに依存しない活性が不可逆的に増加することにより、ATPの効果が消失していることがわかったのです。ケンブリッジ市に住んでいた私は、ボストン市にある大学に、毎日スクールバスで通っていましたが、この実験データを見た時は、興奮して最終バスを逃してしまいました。マイナス20度の中、2時間かけて歩いて帰りましたが、寒さを感じずむしろその間ずっと体がぽかぽかしていました。このような経験は長い研究生活でも数えるほどしかありませんでしたね。ここで私は、不安定な未知酵素の存在を予見するだけでなく、グリセリン効果を利用すればこのタンパク質分解酵素を分離できるに違いないと確信しました。
当時、真核生物の細胞質に未知のタンパク質分解酵素があるらしいという知見は、世界的に散見していましたが、誰もその実体を明らかにすることができなかったのです。クロマトグラフィーでタンパク質分解の活性をモニターしながら精製を進めますと、1つの対照的なピークとして溶出してくるのが普通ですが、この未知のタンパク質分解酵素の場合は、考えられないほど多くのピークが折り重なって出てくるのです。ゴールドバーグの研究室での任期は終わってしまい、帰国後グリセリンの効果を利用して精製を試みました。すると予想どおり、あらゆる真核生物からいとも簡単に、しかも大量に未知の酵素が精製できました。二次元電気泳動で分析しますと、分子量が数万のサブユニットが約15個から構成された分子量約75万、沈降係数が20Sの酵素複合体でした。後に20Sプロテアソームと呼ばれるプロテアソームの一部が得られたのです。当時知られていたトリプシンやキモトリプシンなどのタンパク質分解酵素の分子量は数万程度であり、新たに発見したこの酵素はとてつもなく大きかったのです。この酵素に名前をつけるためにゴールドバーグが来日して、話し合うことにしました。当時、複合体型のタンパク質分解酵素という概念がなかったので、最初はタンパク質複合体という意味でプロテオソーム(タンパク質の複合体粒子という意味)と名前を付けるのが無難であろうと話がまとまりかけたのですが、やはり発見した経緯と機能を表したいとの思いがあり再考しました。そして名付けたのが、プロテアソーム(プロテアーゼ活性を持つ巨大粒子という意味)です。もしプロテアーゼ複合体というアイデアが間違っていたら、私たちの将来はないねと笑いながらこの名前に命運を賭けたのです。このときゴールドバーグは、大阪行きのチケットが取れなかったから成田まで迎えに来てくれと連絡してきたので、千葉の成田山新勝寺に連れて行きその境内で討議しました。徳島からだと大阪と成田はえらい違いなのにと、かつてのボスの非常識さに腹を立てながら成田に向かったことを今でも覚えています。

帰国した1983年にA.L.ゴールドバーグ教授と、広島散策の帰路に立ち寄った姫路城にて。
プロテアソームの構造を観る
複合体酵素ですから二次元電気泳動をすると、沢山のスポットが出ます。生化学会で発表したスライドを見てたある偉い先生が「大部分のスポットのうちの一つがプロテアーゼであるはずだ。このようないい加減なデータを神聖な生化学会で発表すべきでない」と厳しく非難されました。これまでの酵素の概念を覆すものでしたから仕方なかったのですが。精製酵素の単一性をクロマトグラフィーや電気泳動などで示しても、説得力はありませんでした。そこで、精製したプロテアソームを酢酸ウランで染色し、電子顕微鏡で観察したところ、筒状の複合体である白いプロテアソームの姿が浮かび上がりました。百聞は一見に如かず、とは言いえて妙であり、その後この酵素に対する疑義は払拭されました。写真とモデル像を論文に掲載したところ、ドイツのマックスプランク研究所のW. バウマイスターが徳島までわざわざやって来て、「自分は電子顕微鏡で分子を見るナンバーワンだから共同研究しよう」と誘ってくれました。以来、ずっと共同研究を続けています。
続いて1988年、タンパク質構造討論会(現在の日本蛋白質科学会の前身)で、プロテアソームについて講演したところ、九州大学の岩永貞昭先生(同大学名誉教授)に「酵素の活性中心の構造を決めないことにはプロテアーゼとは呼べません」と指摘されました。そこで、単離した数十本のサブユニットを持って、岩永研究室を訪ね、「この一次構造を決めてください」とお願いしたら、「エドマン分解法でやっていたら100年かかる」と言われました。幸い遺伝子工学が日本にも導入され始めた頃で、岩永先生がその場で京都大学の中西重忠先生(現・大阪バイオサイエンス研究所所長)に電話してくださいました。1時間ほどの電話の後、「中西先生が話を聞いてくれるそうだからすぐに行きなさい」と言われたので、喜んで会いに行ったところ、中西先生は「プロテアソームなんて知らない」とすごく機嫌が悪いのです。当時の中西研には、日本全国から遺伝子クローニング技術習得のために多くの研究グループの人たちが来ていて、「とてもじゃないけど面倒見切れないよ」とつれなく言われました。「なんで呼んでくれたのですか」と訊ねたら、「君の話を聞くと言わないと、岩永先生が電話を切ってくれなかったからだ」と言われましてね(笑)。ああ、もうダメかと思ったのですが、研究室セミナーで発表したところ、中西先生が「こんなに面白いものがあるなんて知らなかったよ。全面協力する」と約束してくださったのです。最初の対応とは正反対、非常に嬉しかったですね。研究室の一番いい場所を空けてくださって、遺伝子クローニングは垣塚彰博士(現・京都大学生命科学研究科)にお世話になりました。この協力のおかげで、プロテアソームのサブユニットのうち、約7割の一次構造は私の研究室で決めることができました。この結果、プロテアソームの物質的基盤がかたまり、私の研究が世界で信任を得ることになったのです。
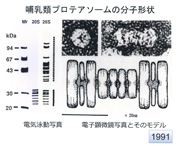
26Sプロテアソームの分子構造。左:20Sと26Sプロテアソームの電気泳動写真。右上:世界最初の26Sプロテアソームの電子顕微鏡写真。左が上から見た図、右が横から見た図。(1991年に猪飼篤博士が撮影)右下:モデル図。
分子の全体が見たい
プロテアソームの精緻な立体構造については、当時、徳島大学の工学部にいらした月原冨武先生(大阪大学名誉教授)に力を貸していただきました。非常に先見性のある方で、当時から「これからのタンパク質の構造解析は数をこなすのではなく、巨大で複雑なタンパク質に挑まなければダメだ」とおっしゃっていました。世界はリボソームの構造解析で凌ぎを削っていた頃でした。この観点から見ると、リボソームに匹敵するプロテアソームは恰好の材料でした。
そして約10年かけて解明したプロテアソームの高次構造は非常にユニークで美しいものでした。ただこの時解明した構造は、20S Core Particle(CP、別名20Sプロテアソーム)と呼ばれるようになった触媒粒子で、αリングとβリング(各々7種のサブユニットから構成)がαββαの順で会合した分子量75万の円筒型粒子(α1-7β1-7β1-7α1-7)でした。

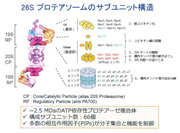
後に判明することになりますが、ユビキチン化タンパク質をATP依存的に分解する活性型の26Sプロテアソームは、CPの両端に調節粒子である19S Regulatory Particle(RP)が会合した、分子量250万、総サブユニット数66個から構成された多成分複合体です。活性型プロテアソームの電子顕微鏡写真はW.バウマイスターと共同研究で撮影しました。そのユニークな構造から数多くの雑誌の表紙を飾ってきました。RPはlid(蓋部)とbase(基底部)から構成されており、lid複合体とbase複合体は、各々10個と9個のサブユニットから構成されています。蓋部にあるnon-ATPaseサブユニットRpn10とRpn13と名付けられたサブユニットがポリユビキチン鎖を識別して基質タンパク質を捕捉するユビキチンリセプターです。
一方Rpn11は、ユビキチンを再利用するために、ポリユビキチン鎖を根本から切断して解離させる脱ユビキチン化酵素として働きます。基底部は6種のAAA型ATPaseサブユニット(Rpt1~Rpt6)を含んでおり、この冠(Crown)型構造のATPaseリングは、触媒粒子のαリングと結合してその中央部のゲートを開き、基質タンパク質の通過を可能にさせます。またこれは、ATPの加水分解エネルギーを利用してタンパク質の3次元構造を破壊(アンフォールディング)し、変性した基質がαリングを通ってβリングの内部に到達できるようにするアンチシャペロン作用を持っています。真中にある20S CPのβリングは、カスパーゼ型(β1)、トリプシン型(β2)、キモトリプシン型(β5)の3つの触媒活性を持っていて、その活性中心がリングの内側表面に露出しています。この部分で標的タンパク質を加水分解しますが、αリングは中央が非常に狭い構造をしており、通常はこのαリングが閉じているため、20S CPは細胞内では不活性型として存在しています。ATPaseリングとCPのαリングが結合することによって、中央部のゲートがひらき、それと同時に、ATP加水分解エネルギーを利用して、基質タンパク質の3次元構造を壊し、ひも状に変性させます。こうして、高次構造をもったタンパク質がβリングの内部に到達でき、分解が可能になるのです。これら一連の解明によって、私が1983年に「エネルギー依存性の2段階説」で発表したATP依存のタンパク質分解機構の詳細がやっとつかめました。1953年のM.V.シンプソンの発見から約半世紀という長い時間がかかりましたが、非常に大きな成果を残すことができたと思っています。結果的にタンパク質分解のためのエネルギーはユビキチンによる基質の識別とRPによるアンフォールディングに使われており、加水分解反応には使用されておらず、熱力学の法則に違反することはありませんでした。
26Sプロテアソームの高次構造。
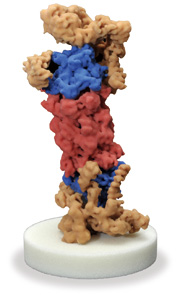
26Sプロテアソームの模型(赤:触媒粒子、青と黄:調節粒子)。独マックスプランク研究所のW.バウマイスター(Wolfgang Baumeister)教授からのプレゼント。
プロテアソームの多様性の発見から免疫の世界へ
プロテアソームは不要なタンパク質をユビキチン化して選択的に分解するタンパク質分解酵素という役割が主な機能ですが、近年はそれ以外の役割もわかってきました。例えば、免疫機構との深いつながりがあるのです。主要組織適合遺伝子複合体(MHC)主要組織適合遺伝子複合体(MHC)移植免疫において、最も強い移植片拒絶反応を引き起こす細胞表面の同種抗原およびそれらを支配する遺伝子群。この複合体は分子構造と組織分布から大きくクラスⅠ抗原とクラスⅡ抗原に分けられる。クラスⅠ抗原はほぼすべての体細胞上発現されるのに対し、クラスⅡ抗原はB細胞や抗原提示細胞など一部の細胞だけで発現される。を獲得した脊椎動物は、多様な病原体を非自己として識別し排除するという適応免疫能を持ちます。例えば体内に侵入したウイルスなどの病原体や細胞内で発生したガン抗原は、細胞質内でペプチド断片まで分解され、小胞体内に輸送後、MHCクラスⅠ分子と結合し、細胞表面へと運ばれます。そして、MHCクラスⅠとペプチド断片の複合体を目印として、CD8+T細胞が認識し、最終的にはこのキラーT細胞が感染細胞を破壊します。けれども、感染した病原体がどのように分解されて、抗原ペプチドとなるのかは長い間不明でした。抗原ペプチドの輸送機構(TAPトランスポーター)の発見が皮切りとなって、1994年にプロテアソームの阻害剤を用いた研究から、プロテアソームが内在性抗原を処理して抗原ペプチドを生みだす酵素であることが分かりました。面白いことにこのプロテアソームには多様性があり、細胞をインターフェロンγインターフェロン(略記:INF、IF)ウイルスや2本鎖RNAなどによって動物細胞から誘発される抗ウイルス作用をもったタンパク質の総称のこと。INF-γはT細胞により産出され、白血球の一種であるマクロファージの活性化やクラスⅠ・ⅡMHC誘導活性作用、抗原提示機能増強作用など独自な免疫応答調節活性能を持つ。などのサイトカインで処理しますと、通常型20Sプロテアソームの触媒サブユニットβ1、β2、β5が、これらのサイトカインによって強く誘導されたβ1i、β2i、β5iとそれぞれ置き換わっているのです。私たちは、このサイトカイン誘導型のプロテアソームを“免疫プロテアソーム”と命名しました。

免疫プロテアソームは通常型プロテアソームよりも高いキモトリプシン様活性を持つため、MHCクラスⅠとより結合しやすいペプチドを効果的に産出できることがわかりました。そして近年では、β5i遺伝子(PSMB8)のコドン内の塩基の変化によって起こるミスセンス突然変異が、中條-西村症候群(Nakajo-Nishimura syndrome)を引き起こすことが判明しています。これは、プロテアソームの形成不全によってその活性が低下し、適切に分解できないタンパク質が異常に蓄積することで引き起こされる炎症性疾患です。プロテアソーム遺伝子と疾患を結びつける最初の症例となり、同じ遺伝子が変異した家系がメキシコやポルトガルでも見つかっていることから、世界的に注目されています。
1998年に東京都臨床医学総合研究所でひらかれた、ユビキチンとプロテアソームの国際学会のポスター。初めて国際学会の主催を任され、日本の国際学会では珍しく外国人講演者を多数招待し、内容の濃い国際学会であったと好評を博した。
胸腺プロテアソームの発見
免疫プロテアソームの発見により分子免疫学にも貢献できたと思い、嬉しい気持ちで一杯でしたが、その後村田茂穂君(現・東京大学薬学研究科教授)がさらに大きな発見をしてくれました。2007年、Expressed Sequence Tag(EST)という組織特異的に発現しているcDNAの情報データベースを検索したところ、胸腺だけに大量に発現しているプロテアソームサブユニットのcDNAがありました。それは通常のプロテアソームβ5および免疫プロテアソームβ5iと高い相同性を持ち、実験の結果cTEC内でこれらの代わりにプロテアソームに組み込まれることがわかりました。胸腺で見つかったこの新しいサブユニットをβ5t、それが組み込まれたプロテアソームを“胸腺プロテアソーム”と名付けました(パートナーの触媒サブユニットはβ1iとβ2i)。
ところで胸腺には、有用なT細胞を選り分け、有害なT細胞を除去する役割があります。学術的にはT細胞の分化というべきですが、免疫の世界では、これをT細胞の“教育”と呼んでいます。まず、胸腺皮質上皮細胞(cTEC)の働きによって有用なT細胞だけを選び(=正の選択)、続いて胸腺髄質上皮細胞(mTEC)や樹状細胞の働きによって自己と強い反応を持つ有害なT細胞を排除するのです(=負の選択)。胸腺の皮質では遺伝子再構成によって多様なTCR(T細胞受容体)を獲得したダブルポジティブ(CD4+CD8+陽性)T細胞がシングルポジティブ(CD4+あるいはCD8+)陽性T細胞に分化します。正負の選択は、ダブルポジティブT細胞のTCRとcTEC/mTECに発現しているMHC—ペプチド複合体との親和性で決定されるというAvidity Modelが免疫の世界を席巻してきましたが、その実体は全く不明でした。私たちはβ5tの遺伝子を欠くマウスを作出して、このCD8+陽性T細胞のレパトア(バーネットが提唱したクローン選択説におけるクローン)形成に胸腺プロテアソームが必須な働きをしていることを明らかにしました。すなわち、胸腺プロテアソームが胸腺における正の選択を駆動する抗原ペプチドを生成していることを示唆したのです。β5tの遺伝子を欠くマウスでは、正の選択が正しく行われないため、CD8+T細胞の数が著しく減り、リンパ球への分化に異常(正常なレパトアの形成不全)をきたしていることがわかりました。私たちが胸腺プロテアソームを見つけるまでは、T細胞のレパトア形成には負の選択のみで十分であり、正の選択は不要であると欧米の免疫学者たちは考えていたのです。胸腺プロテアソームが発見されて状況は一変、世の中は「正の選択」仮説に転じました。免疫学の教科書の書き直しが始まっています。私は免疫学者ではありませんが、胸腺プロテアソームが免疫の基本である自己と非自己の識別に深く関わっていることを発見できて幸運です。免疫プロテアソームと胸腺プロテアソームの発見は、タンパク質分解という小さな世界が、予期しなかった免疫との邂逅を通して生命科学の中枢へと進む原動力になったのです。
第34回ノーベル会議での講演者と。著名な科学者が勢揃いし驚いた。(本人:2列目の左から3番目、A.ハーシュコ:前列中央、A.L.ゴールドバーグ:前列左から3番目、W.バウマイスター:2列目左から2番目、A.チカノーバー(Aaron Ciechanover):2列目の左から7番目、柳田充弘:前列右から3番目)
第34回ノーベル会議の開催場ノーベルフォーラムの正面玄関にて。柳田充弘教授(右から2番目)と私が講演した。(本人:中央)

2004年朝日賞の授賞式にて。受賞後のスピーチでは「賞金をアルコールに使います」と話し、会場を笑いの渦で包んだ。
2009年還暦祝いの時。最近10年(現在も含む)のほとんどのメンバーが出席してくれた。(本人:中央、村田茂穂博士:前列右から2番目)
分子集合機構の解明へ
今、世界で注目されている仕事がもう一つあります。私は、プロテアソームのような超分子複合体がどのようにして出来上がるのかに興味を持って研究を進めてきました。例えば、CP部分のαとβリングの7種のサブユニット構造は非常によく似ていますし、一個ずつが正確に並んでいます。こんな芸当がどうしてできるのだろうと非常に不思議でした。産総研の夏目徹博士らが開発した高感度のタンパク質間の相互作用解析システムを使った結果、プロテアソーム形成に特異的に働く多くのシャペロン分子群を発見できました。例えば、PAC(proteasome assembling chaperone)1とPAC2の2量体は20S CPを構成するαリング同士が凝集するのを防ぐことによって適切な分子集合を保証しますし、PAC3とPAC4の2量体はαリングへのαサブユニット群の結合を促進しています。また19S RP複合体を構成するATPaseリングの形成を支援する特異的な4個のシャペロン分子も世界に先駆けて発見しました。そしてこれらの形成過程は、酵母からヒトまでよく保存されていることがわかりつつあります。シャペロン依存的な多成分複合体の分子集合と言う概念は、リボソームなど細胞内に存在する他の多くの超分子複合体の形成機構の解明の基盤となると考えており、学術的な波及効果は計り知れないと思っています。
様々な幸運に導かれて
私は東京大学や京都大学の出身ではありませんので、学閥の恩恵を受けたことは一切ありません。ただ、プロテアソームが非常に面白い分子であったことから、この分子に興味を持った多くの人に助けられて研究を続けることができ、その結果として大きな成果を残せたことは幸運だったと思っています。研究者は、多様なつながりの中でこそ自分の力を最大に発揮できるものですから、若い研究者たちにも自分の専門分野を超えて、いろいろな人と議論し協力して研究を進めて欲しいと願います。 2004年にユビキチンシステムにノーベル化学賞が授与されるまでは、「タンパク質分解などというあまり意味のない研究をやっている」と分野外の研究者には思われていたかもしれません。事実、当初は「タンパク質の分解なんかやって何が面白いの」と多くの人に言われ、研究の意義に共感してもらえないこともありました。けれども、自分でゴールドバーグの論文を見出し、研究人生を捧げるのはこれだと直感し、一意専心の思いで研究に邁進してきました。研究にはこんな進め方もあっていいと思います。
また、ゴールドバーグがハーバードに呼んでくれたおかげで、ユビキチンの発見直後に、その研究の最新の動向を一番早く見聞き出来る環境に居合わせたことも幸運でした。プロテアソームシステムの破綻がきっかけとなって発症するガンやアルツハイマー病、自己免疫疾患なども多く見つかっています。私自身はタンパク質分解機構を中心とした基礎的な研究を進めてきましたが、現在ではプロテアソームの阻害剤が出色の抗ガン剤として開発されて、多くの命を救っています。ヒトの健康を守る研究への予想外の発展があったのです。プロテアソーム発見時、それに関わる論文はほとんどゼロでしたが、今では年間3000以上の論文が発表されており、大きな研究分野へと展開しています。発見者として嬉しい限りです。新しい発見をしてからしばらくは敵がいませんから、のびのびと研究が出できますし、非常に楽しいです。この体験から、若い人には臆せず、面白いと思う独創的な研究に挑戦して欲しいと思っています。

2010年日本学士院賞受賞式にて。中西重忠先生にお祝いの言葉をいただき非常に嬉しかった。
日本学士院賞受賞のお祝いに、研究室の皆からもらったプロテアソームのイラスト入りネクタイピン。
2011年慶応医学賞授賞式にて。流行を創る研究を目指すこと、運を味方に引きつけることという2つの信条を軸にこれまでの研究について講演した。
札幌でひらかれた2回目のプロテアソーム国際学会にて。講演者を計26名招待し、活発な学会となった。

研究室のみんなへのお礼を込めて、メンバーとその家族を連れて山形の上杉神社へ旅行に。桜がとてもきれいで皆が喜んでくれた。
| [受賞等] | |
| 1988年 | 日本生化学会奨励賞 |
| 2003年 | 内藤記念科学振興賞 |
| 2004年 | 上原賞 朝日賞 |
| 2005年 | 東京スピリット賞 |
| 2007年 | 東レ科学技術賞 |
| 2009年 | 武田医学賞 ナイスステップ研究者賞 |
| 2010年 | 日本学士院賞 徳島新聞賞 徳島大学栄誉賞 |
| 2011年 | 日本内分泌学会マイスター賞 慶応医学賞 |