起源と展開の中で理解したい
「?・・・・・!」、これが定年退官の時の最終講義のタイトルです。私の科学に対する姿勢が込められているのですが、音読できないタイトルに、紹介する方としては困ったでしょう。このタイトルには二つの意味が込められていています。一つは、「どうなっているのだろう、から始まって、そうだったのか、と腑に落ちる」つまり、しくみを知ること。もう一つは、「でも何故そうなっているのだろう、から始まり、そういうわけだったのか、と腑に落ちる」つまり、起源と展開を知ることです。どんなことにも始まりがあり、展開があり、終わりがあります。物質も空間も宇宙も銀河も太陽も地球も人類も人生も然りですね。だから起源を知り、由来を知ることこそ理解することだと思うのです。生物がこれだけ巧妙にできている、ということを明らかにするだけでは、まだ本質が分かったことにはならない。私は生化学という切り口でATP合成酵素のメカニズムを研究してきたのですが、こんな複雑巧妙なものがどうやって自然にできてきたのか、その歴史も理解したいと思っています。なかなか切り込めませんが、生きているうちには知りたいですね。

東工大退職記念吉田研同窓会にて
読書に明け暮れた少年時代
太平洋戦争末期の1944年2月に群馬県の前橋で生まれました。生家は煎餅屋。男ばかり4人兄弟で賑やかに育ちました。いつも兄貴の後について、網で魚をとったり、虫を探したりと忙しくしていましたね。と言っても、主役は兄で私は助手。カゴをもって後を追いかけていたものです。小学生の低学年の頃から家業の手伝いをしていて、夏休みも午前中は毎日働いていました。夕方になってもにわか雨が降ると「まさすけ!」と呼ばれて、慌てて屋根の上に干してある煎餅を片づけるのです。商売をする父は、開発されたばかりのテフロン樹脂をアメリカから個人輸入して煎餅生地の型枠に塗布し、生地の脱離を容易にするなど、いつも人の思いつかない工夫をしていました。父からは常に新しいことを探す姿勢を学びました。
その頃は、小学校の図書室も立派なものではありませんでしたが、そこから本を借りて読むのが日課でした。学校中で一番たくさん本を読んだ子供だったかもしれません。学校の行き帰りも歩きながら本を読み、まるで二宮金次郎みたいだと思っていました。小学校3年生の時、オパーリンの『生命の起源』と出会い、よくわからないままに何度も読み返しました。コアセルベートというコロイドの溶液から細胞が生まれたと書かれていました。生命には起源があること、しかもそれは神様がつくったのではなく、化合物が自然に寄り集まって生まれたという主張が強く印象に残りました。恐竜よりも生命の起源に興味があるのですから、ちょっと変わった小学生だったでしょうね。
中学校のときには部活で卓球に熱中しました。店が閉まった後、煎餅の作業台の上に板を置いて、よく従業員とピンポンをしたものです。夢中になりすぎるくらい。でもおかげで県大会では優勝しました。ただ、あの頃は、全国規模の中学生の体育大会が禁止されていて、もっと腕を試したかったのに残念でした。高校では卓球と勉強で手一杯で本を読む暇がなく、今思うと不毛な時代でした。大学に行ったらあれやろう、これやろうとみんな後に預けてしまった感じがします。本当は京大を目指していたんです。文化の香りが高いイメージがありますからね。ところが、高校3年生の時先生に「おまえは東大へ行け」と言われ、情けないことにそのまま素直に従ってしまいました。

生家の前で母親と兄弟、下宿していた群馬大学生の家庭教師のお兄さんと(後列真ん中:本人)

小学生の同級生と。本好きな少年だった(前列左端:本人)
生化学へ足を踏み入れる
大学に入って、自由な時間が手に入り、ここぞとばかりに本を読みあさりました。ランダウというソ連の物理学者の書いた「統計物理学」には、他の人とは全く違う視点からエントロピーを定義している点に感動しましたし、朝永振一郎さんの「量子力学」も熱心に読みました。名著ですね。もっとたくさん書いて下されば良かったのにと思います。その他、「平家物語」、エンゲルスの「家族、私有財産、国家の起源」、丸山真男の「現代政治の思想と行動」などいろんな分野に興味をもって片っ端から読みました。
東大に生物化学科ができて間もないころで、『生命の起源』の影響もあって、漠然と生命の基礎的な研究をしたいと思っていた私は、その名前の印象に惹かれて進学しました。卒業研究は、RNA分解酵素などの研究で有名な江上不二夫先生(東京大学名誉教授)やタンパク質化学の最先端の研究をしていた安藤鋭郎先生(東京大学名誉教授)の研究室には目もくれず、何やらおもしろそうなことをやっているという印象だけで野田春彦先生(東京大学名誉教授)の研究室へ進みました。テーマはウサギの筋肉からミオシンというタンパク質を取り出してその重合を調べることでした。ミオシンは筋肉の研究で有名な医学部の江橋節郎先生(東京大学名誉教授)のところで調製し、それを持って帰って解析したものです。実は、私は憶えていないのですが、溶液を計りとるガラスピペットを直に実験机に置いては、先端が汚れると何度か注意されていたらしいんです。筋肉研究者の間ではしょうもないやつだという話が広まっていたと聞いて恥ずかしい限りです。私の記憶にあるのは研究室で江橋夫人に作っていただいたラーメンの味です。
当時、学生寮の委員長をしていたものですから、寮運営費の負担をめぐって大学と対立していました。その時の大学の担当者の一人がなんと野田先生で、研究室のセミナーで私が論文紹介をして質問にうまく答えられなかったら、「寮委員長などをやっているからだ。」と叱られました。これはたまらないと思い、大学院の進学は外へ飛び出そうと考え、教養学部でタンパク質の生合成の研究に取り組んでいた今堀和友先生(三菱化学生命科学研究所名誉所長)に会いにいきました。モデルを考えて研究を進めるスタイルに魅力を感じて、リベラルそうな雰囲気にも惹かれ、研究室に入れていただきました。

Scientist Library:
季刊 生命誌 12号
『カルシウムと私』
江橋節郎

Scientist Library:
季刊 生命誌 18号
『タンパク質と私の研究遍歴』
今堀和友
モデルを考えながら研究をすすめる
今堀先生から出された研究テーマは、「タンパク質生合成を担うリボソームを構成するRNAは、リボソームのタンパク質を コードするmRNAでもある」という仮説を証明する、というものです。結局この仮説は間違っていたのですが、今堀先生のモデルですから一生懸命やりました。1年後、どうしてもうまくいかないので、「もうやめます」と宣言しました。しかも、「先生は指導者としてもう少ししっかりしてもらわなきゃ困ります」とマキャベリの『君主論』を渡したりしたんです。可愛い気のない学生だったでしょうね。かといって全く違うテーマに取り組む実力もなかったので、考えた末にそれまでの研究の延長として酵母のリボソームRNA遺伝子の個数を決めるという実験を始めました。当時、使われ始めたばかりのRNA‐DNAハイブリダイゼーション、つまり相補的なRNAとDNAがくっつくという方法を利用しました。リボソームRNAと酵母のDNAを混ぜてくっついたものだけ選び出して数えたのです。意外なことに、酵母にはリボソームRNAの遺伝子が何百個もあるという結果が出ました。同じ遺伝子が何百個もあったら、どんどん勝手に進化してしまうだろうし、おかしいと思い悩んだまま論文にはできず、お蔵入りにしてしまいました。今堀先生とつきつめて議論していなかったので論文を書く自信がなかったのです。しばらくして、フランスの研究者が同じような結果を発表した時には少し残念でしたが、一方で、自分の結果は正しかったのだと自信もつきました。
好熱菌と出会う
修士課程は出版論文を書けずに終わったので、博士課程では何か新しいことをやりたいと思っていました。ちょうど大島泰郎さん(現環境微生物学研究所所長)がアメリカから颯爽と帰ってきて今堀研究室に助手として就任し、温泉に住む好熱菌の生化学を始めたのです。面白そうだと思い、私も参加し、好熱菌だからこそ意義のある研究テーマを考えました。当時、調節因子の結合によって活性が調節されるアロステリック酵素は熱に弱いとされていました。高温にさらすと、酵素活性は残っていながら制御機能を失うアロステリック酵素の例があいついで報告されていたのです。しかし、75℃で暮らす好熱菌でも、生きていくには酵素活性を調節する必要があるはずです。そこで、アロステリック酵素でなければならないはずのホスホフルクトキナーゼに注目しました。この酵素は、エネルギー代謝の中心となる解糖系の中でATPを使って糖をリン酸化します。細胞質には、この、逆反応の脱リン酸化をおこなう酵素も同時に存在しています。この二つの酵素が同時に働いたら、大事なATPを浪費するだけですから、ホスホフルクトキナーゼの活性は必ず調節されているはずなのです。
まずは酵素の精製から始めました。当時の精製方法はまだ洗練されていませんでしたが、感度のよい活性測定法と酵素の安定な溶液条件の確立に注意して、純粋な酵素を得ることができました。そして好熱菌のホスホフルクトキナーゼは、高温でも制御機構を失わないアロステリック酵素であることを実証できただけでなく、今まで知られていなかった調節因子を見つけました。この因子は、好熱菌特有のものではなく細菌に共通なものでした。論文のタイトルは”The Thermostable Allosteric Enzyme”です。シンプルでいいタイトルでしょう。 大島さんの口癖は、「研究はアイディア、方法、材料のどれかが新しくないといけない」でした。安直ですが、私は好熱菌という変わった材料で勝負したことになります。修士課程では論文を一報も発表できなかったのですが、博士課程の研究では4つ書きました。そのうち1つは私が単独著者、もう1つは大島さんとの連名で、今堀先生の名前は入れませんでした。こんな生意気なことをやっていて、よく研究室から追い出されなかったと思います。先生方の器量が大きかったと今になって思います。
博士課程の最後のころに結婚し、大島さんから結婚祝いとしてカルビンの『化学進化』という本を頂きました。小学生の時に読んだオパーリンの『生命の起源』は考え方だけでしたが、『化学進化』には多くの実験や測定の結果が紹介されていて感銘を受けました。最初の生命体が生まれる前後の有機物の進化を論じており、特に、30億年以上も前の岩石から抽出した炭化水素が直鎖で偶数炭素を含むなど生物由来を思わせる、というところにはワクワクしたものです。化学進化を研究しているアメリカの研究室へ留学希望の手紙を書きかけたほどです。しかし、生命の起源や進化はまだ実験科学としては未熟だとも感じ、それを横目で見続けながらタンパク質の研究に突き進むことにしました。

Scientist Library:
季刊 生命誌 43号
『縁から中心を捉える科学−好熱菌を通して』
大島泰郎

大島泰郎さん(左)は大学院時代の恩師。那須山にて

大学院時代の4つの論文

大島さんから結婚祝いに頂いた『化学進化』

大学院自治会長として仲間と一緒に書いた『東大変革への闘い』
好熱菌に救われる
博士号はとったもののすぐには職も見つからず、面接を受けてもつい生意気なことを言ってしまったり、なかなかうまくいきませんでした。結局、香川靖雄先生(自治医科大学名誉教授)がコーネル大学から帰国して新設の自治医科大学に着任することを聞いて、手紙を書き助手として採用していただきました。香川さんは、生命のエネルギー通貨であるATPをつくるミトコンドリアのATP合成酵素について最先端の研究をしていました。この分野では、英国のピーター・ミッチェルが、ミトコンドリアや葉緑体、細菌のATP合成酵素は膜を介した水素イオンの濃度勾配を利用してATPを合成している、という化学浸透説を提唱していましたが、長い間無視されていました。ところが、アンドレイ・ヤーゲンドルフが暗闇でも植物の葉緑体を酸性からアルカリ性に移して水素イオンの濃度勾配を作ればATPができることを発見し、化学浸透説が見直されるようになりました。それでも、学界内には半信半疑の雰囲気が漂っていました。確実な証明には、混じり物のない精製したATP合成酵素で実験する必要があったのです。香川さんの扱っていたウシからは不純物の混じったATP合成酵素しかとれない状況でした。そこで、安定なタンパク質をもっている好熱菌なら完全に精製できることを期待して私を助手に採用したのでしょう。好熱菌に救われた形です。
私は、好熱菌という変わった環境に暮らす生きものを使って生命の基本を解き明かしたかったので、すべての生物にとって重要で、いまだ神秘に満ちたATP合成酵素をテーマにできることが嬉しくてワクワクしました。ATP合成酵素は膜に埋まっているFo部分と膜外のF1部分に可逆的に分離できます。F1にはATP加水分解活性があり、これはATP合成活性の逆反応であるとされていました。そこで、F1を酵素学的に調べることにしました。まず大島さんの好熱菌ライブラリーの中からATP加水分解活性の強そうな菌を選び、大きな風呂のような培養タンクを研究室の中に作ってどんどん培養しました。高温なのでタンクの滅菌も必要ありません。期待通り酵素は安定で、不純物の混ざっていないF1が精製できました。ウシのものとびっくりするくらいよく似ていて、F1の普遍性に香川さんとともに喜びました。一方、FoとF1から成るATP合成酵素の精製は、同じく香川研究室に赴任してきた曽根旉人さん(九州工業大学名誉教授)が担当しました。ATP合成酵素は膜に埋まっているので、界面活性剤を加えて膜を溶かす必要があります。界面活性剤が強すぎるとタンパク質も壊してしまうので、種類と操作条件の選択は微妙です。ウシではここで行き詰まっていましたが、ここでも好熱菌はありがたく、曽根さんはATP合成酵素の完全精製に成功しました。
次は、ATP合成酵素が水素イオンの流れだけで本当にATPは合成できるのか、という問題です。それには膜を介した水素イオンの濃度勾配を作る必要があります。ここで私は、ちょうどそのころ論文発表されたばかりの好塩菌のバクテリオロドプシンというタンパク質に目をつけました。光をあてると水素イオンを運ぶポンプです。早速、発見者に手紙を書いて、バクテリオロドプシンをつくる好塩菌を送ってもらいました。床に蛍光灯を敷き詰めて、その上にやぐらを組みアクリルの透明な水槽を置き、24時間照らし続けてぶくぶく通気し、好塩菌を大量培養しました。飽和食塩水で成長する菌なので滅菌操作は不要です。食塩水があふれて床の蛍光灯にかかり、漏電で火事になりそうになった、という失敗もありましたが、この装置のおかげでバクテリオロドプシンを精製できました。これをATP合成酵素と一緒にリポソームリボソーム細胞膜の脂質二重膜を摸した小胞のこと。リン脂質など、疎水性と親水性を併せ持つ脂質を水溶液中で攪拌することでできる。に組み込み、光を当てて生成するATP量を測定するのです。本当にうまくいくのか、はらはらしながら装置の前で測定結果が出てくるのを待ちました。そしたら、トントントンと右上がりにATPの量が増えていったのです。思わず飛び上がって喜びましたね。水素イオン濃度勾配にしたがって流れる水素イオンでATPが合成されたのです。水素イオンの勾配を解消する脱共役剤を入れるとATP合成はピタリと止まりました。実験もたまには思いどおりにいくものだ、と驚きましたよ。これがミッチェルの化学浸透説を証明する重要な決め手となったと思います。この2年後の1978年に、ミッチェルはノーベル化学賞を単独で受賞しました。後に、私たちに会いに自治医科大学まで来てくれました。

自治医科大学のメンバーと(前列右端:本人)

分析装置の前で結果を待つ(左:本人)

風呂のようなタンクで好熱菌を培養

ミッチェル(前列左から3人目)を囲んだ日光でのセミナー(前列右から3人目:本人)
ATP合成酵素と向き合う
次に、非常に安定なこの酵素の性質を生かして、部品(サブユニット)に解体し、それをまた組み立てるという仕事をやりました。F1の(αβ)3γδεというサブユニット構成がわかり,各サブユニットがFoの上に組み立てられていく順番もわかりました。ここまでは、生化学を基本にした実験ですから気分良く進めてきたのですが、この先は大変です。立体構造はもちろん、アミノ酸配列すら分からない分子量約50万を越す巨大な酵素の作用機構をどう研究したらよいのか、思案投首でした。結晶構造解析の重要性は明らかで、多少は手がけていましたが自分が中心でやるには手間がかかりすぎるし、ATP合成酵素の反応速度論(キネティク)はこの上なく複雑で解析不能、と思いました。そんな中、目にとまったのが、ATP合成酵素の活性中心に、基質であるATPにそっくりな物質で目印をつけ、その部分のペプチドを取り出してアミノ酸配列を決めたカリフォルニア大学のウィリアム・アリソンさんの研究です。地味な論文でしたが、アミノ酸配列から機能に直結する研究ができることを示しているところに魅力を感じました。早速手紙を書くと、ぜひいらっしゃいという返事がきました。そこで、培養と精製を繰り返して得た1gのF1を凍結乾燥してつめた瓶をポケットに入れてサンディエゴに渡ったのです。そこで、βサブユニットの活性部位ではグルタミン酸残基が重要な役割をしていること、(αβ)3で初めてF1らしい協同的な活性をもつことなどを明らかにしました。この時期の研究はF1の化学修飾が中心で地味でしたが、家族とともに過ごしたサンディエゴの2年間はいろいろな意味で忘れがたいものです。
日本に戻って3~4年、ようやく東工大の大島泰郎さんの研究室の助教授になれました。医科大学では、理学部出身者は肩身のせまいところもあって、医学部以外に行きたいと思っていたので救われました。
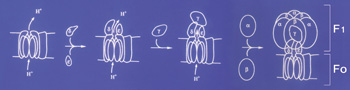
F1の再構成実験

アメリカへの留学中に子どもは4人に増えた
生物界を横断するV型ATPas
東工大に移ると若木高善さん(東京大学教授)がスルフォロバスという好酸好熱性の古細菌にはATP合成酵素がない、とおかしな事を言うのです。調べてみると、それまでに知られているFoF1という構造を持つ典型的なATP合成酵素は確かにありませんでした。かわりに、FoF1に似てはいるけれど明らかに新しいタイプのATP合成酵素を発見しました。しかも、そのサブユニット構成と分子量が、東大の大隈良典さん(現東京工業大学特任教授)がとった酵母の液胞膜のATPase(ATP加水分解酵素)に似ているようなのです。ようやく使えるようになっていた遺伝子操作技術で、遺伝子をクローニングしてアミノ酸配列を決め、ドイツの学会に行きました。そこにカナダの研究者がニンジンの液胞膜にあるATPaseのアミノ酸配列を持参してきていたのです。ともに未発表だったので、学会会場の隅でお互いのアミノ酸配列を1残基ごとに見比べたところ、えっ?えっ!の連続でした。両者が驚くほど似ていたのです。生物界を横断するV型ATPaseの発見の瞬間です。こうして、真核細胞のリソソームや分泌小胞の内部を酸性化するATP駆動型のプロトンポンプであるV型ATPaseの元祖が古細菌にあることになり、古細菌にある種の真正細菌が共生して真核細胞が誕生したという話にまで発展しました。生きものは真正細菌、古細菌、真核生物の3つに分けられるという説はありましたが、私はそれに懐疑的だったのです。はからずも自分の研究結果によって古細菌の存在を実感することになり、ちょっと間の悪い感じでしたが、一つの大きな動きに関わったことは喜びです。

Scientist Library:
季刊 生命誌 62号
『自分を食べて生き残る細胞に魅せられて』
大隅良典

大隅良典さんは学生時代共に今堀研で研究していた仲間
回るはずがないと思って
1979年に私たちがF1のサブユニット構成が(αβ)3γδεであると発表したのをきっかけに、カリフォルニア大学のポール・ボイヤーは回転触媒説を思いつきました。これは後になって手紙で教えてくれました。ボイヤーは、私が解析不能と思っていたF1のキネティックに真正面から取り組み、この奇想天外な着想を得たのです。活性中心が3つあることで初めてATPを加水分解できるので、3ヶ所で順繰りにATPを分解しながら回っているのではないかと考えたようです。回転する酵素なんて前代未聞ですから長いこと誰も回転説を相手にせず、私も信じられないと思っていました。ところが、1994年にジョン・ウォーカー(英国、メディカルリサーチカウンシル)が長い苦闘の末ウシのF1の結晶構造を決めたら、それがまるでモーターのような形をしていたのです。私たちも結晶構造解析をねらっていたので、先を越されて残念でした。それぞれ3個のαサブユニットとβサブユニットが1個ずつ交互に並んでドーナッツ状になり、真ん中の芯棒のγサブユニットを取り囲んでおり、三相交流のモーターにそっくりです。これほどはっきりと構造が機構を示唆するのはめずらしい。ウォーカーは、それまで回転説には見向きもしなかったのに、解いた構造をみてすぐに回転説に変わりました。
ただちに回転説に乗りかえるのはしゃくなので、大学院生だった野地博行さん(東京大学教授)に、回転ではなく、γサブユニットがガラガラと大きく形を変えてATP合成するのではないか、それを調べてよ、と言いました。大きな構造変化をみるために、放射能の強いトリチウム溶液の中にタンパク質を入れて、形が変わったときにどのくらいトリチウムが取り込まれるかを調べる方法で苦労して実験したのですが、余り構造が変わらないという結果になり、がっかりしました。

東工大の研究室のメンバーとお花見(右端:本人)
回るATP合成酵素
そこでやっと、回ってるのかなと思い始めました。問題は、回転の証明です。生化学の実験では決定打にならないので、一分子観察の専門家である木下一彦さん(早稲田大学教授)に相談すると、「これなら割と簡単に証明できるかもしらん、いや、もう世界のだれかがやってるかもしらん」とすぐに回転を直視する実験を始めてくれました。F1部分をガラス板に固定して、蛍光標識した長いアクチン線維を回転軸となるγサブユニットに付着させ、回転を蛍光顕微鏡で見るのです。大学院生の野地博行さんと安田涼平さん(現デューク大学教授)の担当です。これがあっさりくるくると回ってしまったんですね。野地君が「回ってます」って映像をみせてくれても、まだ私は半信半疑でした。皿回しの皿は回ってもそれを支える芯棒は回っていない。それと同じ事が起きているかもしれません。1分子の世界を可視化するイメージングの仕事は、本物を見ていることの確認に慎重である必要があります。すべての確認ができたころにウォーカーが日本に来たのでビデオを見せると、イスから飛び上がって驚きましたよ。ボイヤーにも送ったところ、当時79才のボイヤーが「長い生涯に見たテレビ画像で最も感動した」と言ってくれました。1997年の2月には論文が科学雑誌「ネイチャー」に載り、その年の10月にはボイヤーとウォーカーがノーベル化学賞を受賞しました。またもや受賞を助けた形です。
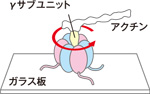
回るF1:F1部分をガラス板に固定し、モーターの回転軸となるγサブユニットにアクチンを付着させた。そこにATPを与えると、反時計回りに回転するアクチンを確認できた。

ウォーカー(右から二人目)と吉田(右端)の自宅で

回転触媒説を提案したボイヤー(左)とテニス対戦の後
制御から捉える
回転することが分かったら、今度は機構や制御が知りたくなりました。細胞にとって、ATPをつくる作業そのものはそれほど難しくないはずです。むしろ生産を制御し、環境が変わったらそれに適応して最適な活性に調整することが細胞にとっては大変だと思うのです。それは、学生時代、アロステリックな酵素を研究している時から思っていました。車だってエンジンがあっても、制御のためのブレーキやハンドルがなければ、恐くて走れないでしょう。ATP合成酵素も体のエネルギーの需要供給の事情にあわせて制御されているはずです。生きものによってそれぞれ環境がちがい制御もさまざまでしょうから、個別に明らかにしなければなりません。
調べてみると、好熱菌では回転軸の根元についているεサブユニットがATP濃度を感知して伸びたり縮んだりすることで、制御しているらしいことが分かりました。ATP濃度が低くなると、ばねじかけのように伸びて回転軸の横に挟まって回転を抑え、それ以上のATP加水分解を止めるのです。人間の場合は、IF1というタンパク質が杭のようにATP合成酵素に刺さって回転をおさえ、ATPの無駄な分解をとめてしまうようです。今、IF1のノックアウトマウスをつくり、その表現形を調べようと思っています。飢えに弱いとか、疲れやすいとか、食っても食っても太らない、などという性質が見られたら面白いのですけどね。ATP合成酵素のエンジン部分が本当にダメだったら生まれてくることもありません。制御の因子の不調なら病気として現れるでしょう。ATP合成酵素の制御の研究が実際に人類の福祉に役立つとうれしいと思っています。
夢 ‐地球外に生命がいたら‐
経験上、基礎科学はどこからブレークスルーが出てくるか全く分からないというのが実感です。私だって、まさかF1が回るとは思っていませんでしたしね。大抵は失敗かもしれないが、時にうまくいく場合があるから、いろいろな個性の人が取り組む方が学問は発展するんだと思います。ですから、少し変わった人は貴重です。学生も生意気なほうがおもしろくていいですね。個性のある人が、ぜひ伸びてほしいと思っています。
ATP合成酵素の精製に始まり、機能や構造を見てきましたが、その結びとして願っていることが一つあります。私が生きている間に、火星に生きものが見つかってくれないか、と思うのです。バクテリアのようなもの一匹でいいから。突拍子もないことのように聞こえるかもしれませんが、比較する対象の生きものが地球外に見つかったら、ATP合成酵素がどうして回るのか、なぜ生物のエネルギー通貨はATPなのか、など生物学の多くの根本的な問いが解けるかもしれないと思うのです。本当に、どうしてこんなに複雑なATP合成酵素が地球に生命が誕生してからわずか数億年の間にできてしまったのか、不思議で仕方がありません。比較するものがあると、広がりが出ますし、展開が見えてきます。地球の生き物だけでは生命の本質はわからないのではないかと思うのです。また、そんな生きものが地球外で見つかったら、地球の中で戦争やっている場合ではないや、となるでしょう。それが私の夢です。

東工大退職後も京都産業大学でATP合成酵素の制御と分子シャペロンの研究をしている。





