
発生生物学を牽引してきた近藤ディレクターが、研究の今を語ります。
発生生物学の静かな革命
近藤寿人(JT生命誌研究館 顧問・表現ディレクター)
-

VOL.1
実験発生学とオーガナイザー
2022.3.15
-
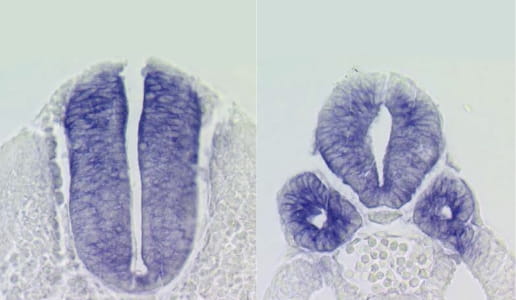
VOL.2
細胞系譜の再検討
2022.06.15
-
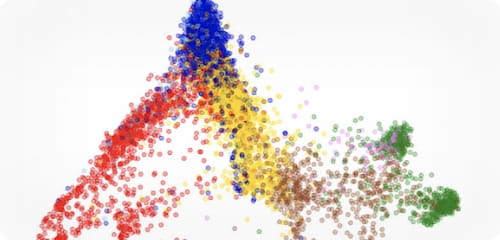
VOL.3
「細胞分化」の意味の変遷
2022.9.15
-

VOL.4
胚のいつ、どこで、何を発生させるのかには
欠かせない抑制機構2022.12.15
-

VOL.5
再生専用の細胞を用いない、
私たちの組織の再生2023.3.15
-
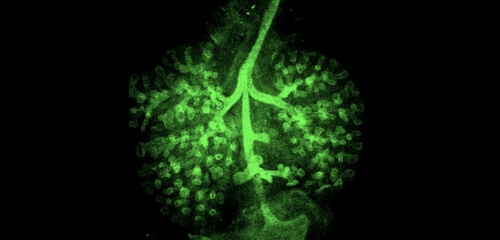
VOL.6
肺の発生にまつわる、2つの話題
2023.6.1
-
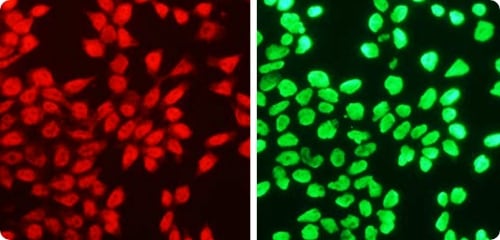
VOL.7
培養皿の中の幹細胞は、
発生の「時」を止めている2023.9.1
-
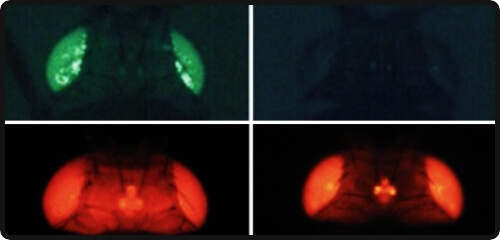
VOL.8
動物の形の多様性という名の変奏曲集I
目と顔と手2023.12.1
-

VOL.9
動物の形の多様性という名の変奏曲集II
てのひらと指2024.3.1
-
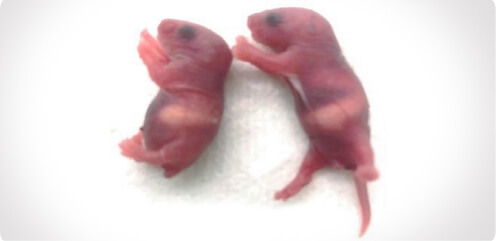
VOL.10
長い尻尾と短い尻尾は、
どのようにしてできるのか?2024.9.1
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)