自由を求めて
1939年の9月5日に名古屋で生まれました。当時は大阪市の近郊に住んでいましたが、母が里帰りして僕を産んだのだそうです。父は京都大学工学部で機械工学を学び、天満織物(現在のシキボウ)という紡績会社に勤めていました。根っからの会社人間でしたから、実は父と一緒に何かをしたという記憶があまりないんです。字が上手だった母からは、「字をきれいに書きなさい」とよく言われたことを覚えています。母は絵も上手で、そのせいか僕も絵が大好きです。母が亡くなったとき、神戸女学院に通っていた頃に描いた風景画(水彩)をもらいました。今も自宅の書斎に飾っています。父の仕事の関係で、小学校1年生から中学校1年生までは富山県大沢野町(現在の富山市)で、中学校2年生までは愛媛県三瓶町(現在の西予市三瓶町)で過ごしました。自然の中でのびのびと自由に過ごすことができたのは、とても良かったと思います。もっとも、教育熱心だった母は、僕たちを早く都会へ出したかったようです。母方の祖父も紡績会社に勤めていたため、三重県の津市など田舎に移り住むことが多く、神戸や大阪に出たときに勉学でとても苦労したんでしょうね。そこで僕は、中学2年生の終わりに兄と一緒に叔父の家に預けられ、東京の雪谷中学校に通いました。

1年間、雪谷中学校で過ごした後、運良く都内で一番の進学校・日比谷高校に入学できました。優秀な生徒がたくさんいて、成績はいつも真中より少し上くらい。小学校からずっとトップでしたからびっくりしましたね。旧制中学のなごりか、授業は先生と生徒が質疑応答する自由な雰囲気で進められ、文系と理系の区別もなく、様々な教養を身につける良い機会になりました。ただし僕は、文科系の科目があまり得意ではなく、特に漢文は散々でした。フルブライトの奨学生としてインタビューを受けたとき、「あなたの成績はほとんどAだけれど、漢文だけは良くありませんね」と言われたことを今でも覚えています。ですから進路についても、漠然とですが理系に進もうと考えました。クラスの皆はほとんど東大を受験しましたが、僕は自由な学風があった京都大学理学部を選びました。

父の転勤で富山県大沢野町に住んでいた頃に家族と。(本人:左端)

左: 日比谷高校時代に、担任の次田香澄先生(下)と。(本人:左から4人目)
右: 同級生らと。(本人:右端)
分子生物学との出会い
入学したのが60年安保の前年でしたから、大学内もそのことで揺れている最中でした。政治や社会に関心をもっている友達に誘われてデモにも参加しました。そんなこともあって教養課程ではあまり熱心に勉強しませんでしたが、化学科に進んでからは真面目でした。そのうちに、化学は伝統的かつ緻密に構成された学問だということが分かってきたんです。当時の理学部はレンガ造りで外見は立派でしたが中に入ると薄暗くて、もっと新しくて夢がある未開拓の部分の多い学問を学びたいという気持ちになりました。4年生になって生化学教室に所属しましたが、代謝マップの穴埋めをするような研究はしたくなかったので、なかなか興味のあるテーマが見つからずにいる時、友人を通じて教室の先輩の山田広美さん(故人)と出会ったのです。
山田さんから分子生物学という新しい生物学が興りつつあることを始め、多くを教わりました。中でもパスツール研究所のフランソワ・ジャコブとジャック・モノーのオペロン説は衝撃でした。その論文を山田さんから紹介されて、辞書を片手に苦労して読んだのを覚えています。遺伝子のはたらきが調節を受けているということを示した1961年の論文です。大腸菌は培地にラクトースを加えた時だけβ-ガラクトシダーゼを作るという巧みな調節をしており、それは遺伝子のはたらきの調節によるというものです。DNAという物質が生きものらしい行動をしているわけで魅力的です。彼らの進め方は仮説をたてて厳密な実験をするというもので、観察中心の現象論的な生物学とは大きく異なります。生命を物質レベルで研究できることがわかり、とても魅力を感じたのです。それからというもの卒業研究はそっちのけで、分子生物学に役立ちそうな発生学の岡田節人教授(京都大学名誉教授、JT生命誌研究館名誉顧問)の講義やウイルス研究所で開かれていた論文読書会に参加しました。
ウイルス研究所には、米カリフォルニア大学で分子生物学を学んで帰国された渡邊格教授(慶應義塾大学名誉教授、故人)がおられました。偉い人なのに学生にも「格(かく)さん」と呼ばれるのです。格さんの分子生物学の講義が僕が所属していた理学部でも行われており、新しい学問ということで湯川秀樹先生(京都大学・大阪大学名誉教授、故人)の教室の助教授も聴きに来ていました。研究室のスタッフや美人の秘書さんも一緒に連れてきて、講義の最中に彼らが合いの手を入れたりして自由な雰囲気がありました。中でも、助手の由良隆さん(元ウイルス研究所所長、京都大学名誉教授)の分子遺伝学の講義はとても素晴らしかったし、何よりかっこよかったですね。20回の連続講義の後に試験があったのですが、ジャコブ/モノーのオペロン説が出題されたので満点でした。さらに遺伝子情報を転写する方法について問う追加問題があったので、それについて利点と限界を表にまとめて提出したら由良さんが随分感心してくれたのを覚えています。そこで「我が意を得たり」という感じで、大学院は分子生物学に進もうと決心したのです。当時の日本では分子生物学を本格的に学べる場所は限られていましたから、いくつかの研究室を直接訪ねて話を聞きました。結局、ウイルス研究所の格さんのところを選んだのですが、入って間もなく格さんに呼ばれて、「本格的に分子生物学を学びたいなら、アメリカに行ったらどうだ」と薦められました。実は格さん、慶應義塾大学に移ることになっていたんですね。当時、分子生物学の研究者はみなアメリカで学んでいましたから、心の中ではシメタッと思いましたね。そして由良さんの紹介で、1963年にカリフォルニア大学サンディエゴ校(UCSD)のデイビット・ボナー教授の研究室に留学したのです。
京都大学理学部の化学科生化学教室のメンバーと。(本人:中央列の右から2人目)

理学部に在学していた頃に先輩・山田広美さんと。(本人:右)

京都大学ウイルス研究所時代の恩師・渡邊格先生と。(本人:左)
楽園のラホヤで
ボナーは分子生物学の第一世代のリーダーの一人であり、彼が主任教授をしていた生物学部は分子生物学を中心に研究が進められていました。当時のUCSDは出来たばかりで大学院しかなく、学生は10名程度で先生の方が多かったのです。図書館は24時間開いていて、毎日本などを机の上に開けてそのままにして帰っても、翌日すぐに勉強が再開でき、食堂は一定のお金を払うと何でも食べ放題でした。おまけにUCSDがあった場所はリゾート地のラホヤでしたから、白い砂浜に紺碧の海と空が広がるまさに楽園でした。そんな環境で大学院生活をスタートしたのです。1年生のときは講義で系統的に基礎的な知識を身に付け、2年生になるとアドバイザーと相談してテーマを決めて研究を進めていきました。1年生の時には講義と併行して、いくつかの研究室にそれぞれ3ヶ月ほど所属します。実際に実験を始める研究室を探すのですが、僕の場合はなかなかしっくり合いそうな教授が見つからなかった。その頃、僕を受入れてくれたボナーは残念なことにサンフランシスコ郊外にある病院で病気の治療をされていたのですが、航空券を手配して僕を呼んで相談に乗ってくれたのです。なかなか状況は変わらなかったのですが、林多紀教授がイリノイ大学から移ってこられたのでその研究室に入ることになりました。
最初は林さんが使っていたΦX174という1重鎖DNAをもったファージ(バクテリアに感染するウイルス)を用いて研究していましたが、その後はラムダファージを使って遺伝子の転写制御を調べる研究に移りました。林さんはラムダファージを使ったことがなかったので、その第一人者であるジーン・ワイグル教授に手紙を書いて分けてもらいました。そして、ラムダファージの遺伝子で初期に発現するものと後期に発現するものの相互作用に注目して、転写調節の分子機構を調べたのです。結局、大した論文は書けませんでしたが、この頃に林さんに習ったハイブリダイゼーションの技術や、自分で学んだ分子生物学の様々なテクニックが、後にバーゼル免疫学研究所に移ってから大いに役立ちました。そして1968年に博士号(Ph.D.)を取得し、博士研究員(ポスドク)としてUCSDの隣にあるソーク研究所のレナート・ダルベッコ教授の研究室レナート・ダルベッコ【Renato Dulbecco】(1914−2012)イタリア出身のウイルス学者。腫瘍ウイルスの感染によって動物細胞のがん化が引き起こされることを明らかにした。これによってハワード・テミンとデビッド・ボルティモアと共に、1975年にノーベル生理学・医学賞を受賞。に移ったのです。
英語の集中レッスンを受けるために、最初に渡米したアリゾナ州トゥーソンで。

大学院生として在籍したカリフォルニア大学サンディエゴ校で実験しているところ。
ダルベッコの薫陶
ダルベッコのところを選んだのはラホヤが気に入っていたこともありますが、多細胞生物を対象にしたいという思いがありました。それまではバクテリアに感染するファージを扱ってきたのですが、ダルベッコのところでは動物細胞に感染するがんウイルスを扱っていました。最初、ダルベッコに手紙を書いたときは予約が数年先まで埋まっているからダメだと言われましたが、彼が半年ほどヨーロッパに出張するために実験台が空くということで運良く採用が決まったのです。博士課程のときに『Proceedings of the National Academy of Sciences』に論文を投稿する際に、アカデミー会員のダルベッコに推薦してもらったいきさつもあり、多少は僕のテクニックを評価してくれたのかもしれませんね。ですから入ってすぐは、ハイブリダイゼーションの技術を使ってアカゲザルから分離したSV40というがんウイルスを使って発現調節のメカニズムを研究していました。その結果は、分子生物学の最先端情報を交換するコールド・スプリング・ハーバー・シンポジウムで発表しました。彼はSV40で見いだされた知見をポリオーマウイルスなどでも調べて一般化したかったみたいですが、僕は発現調節のメカニズムに興味があったのでそれを断りました。
当時、ダルベッコの研究室はがんウイルスでは世界一でしたから、入ってくる情報も圧倒的に多かったですね。しかも極めてオープンな雰囲気でしたから、まだ発表されていない論文が何気なく机の上に置いてあったりして。そういう情報をつかんでおくことは、最先端で研究する際にはとても重要ですから、本当に恵まれた環境にいたと思います。研究室には著名な大学から集まった30人ほどの若くて優秀なポスドク達がいました。彼らはレベルの高い課題以外には見向きもせずに、普遍的な原理を見つけるために仮説を組み立てて、それをどういう方法で実証するかを深く検討していました。そういう同僚達と机を並べて切磋琢磨できたことは、本当に素晴らしい体験だったと思います。ダルベッコ自身も自分の実験台をもっていて、ある程度実験結果がまとまるとラボで発表するのです。最初、僕たちはその重要性が分からないのですが、後からそれが主流になってくることがあって、パイオニア的な実験をしていたのだとわかるのです。彼は細かいことを指示することはなく、この方向に研究を進めたらいいぞという大局観を示してくれました。後から思い返すと、彼の大局観は神がかっているとしか言いようがないほど素晴らしかった。実際に、彼のラボからは彼と僕を含めて5人のノーベル賞受賞者が出ましたから。自分がノーベル賞を取ることはもちろん難しいけれど、それ以上にノーベル賞を取る弟子を育てることはもっと難しいですからね。ダルベッコ先生の薦めもあって、1971年の冬にスイスのバーゼル免疫学研究所に移ったのです。

博士研究員として在籍したソーク研究所のレナード・ダルベッコ(Renato Dulbecco)の研究室でプレゼンテーションをしているところ。
GODのミステリー
バーゼル免疫学研究所はロッシュという世界的な製薬会社が出資した機関で、ダルベッコはそこの顧問をしていました。すでに優秀な免疫学者は集まっていましたが、所長のニールス・ヤーネニールス・ヤーネ【Niels Kaj Jerne】(1911−1994)デンマークの免疫学者。免疫系の発達と制御の特異性に関する理論とモノクローナル抗体の生成原理を明らかにした。これによってジョルジュ・J・F・ケーラー、セーサル・ミルスタインと共に、1984年にノーベル生理学・医学賞を受賞。は優秀な分子生物学者も欲しがっているという事情があったそうです。免疫学には面白い課題が多くあるけれども、分子生物学的な手法を用いた厳密な研究方法がまだ応用されていないということで、ダルベッコは僕にそこを薦めてくれたんですね。研究所にはPh.D.をもった約50名の研究者がいて、テクニシャンと事務のスタッフを含めて総勢150名ほどの人が働いていました。特徴的だったのは、年齢や実績に関わらず全ての研究者がメンバーという名称で雇われていて同等に扱われていたことです。研究者に独立と自由が認められていて、とても僕に合っていましたね。もっとも、僕は免疫学の知識はほとんどありませんでしたから、最初はセミナーに出席しても発表者が言っていることがさっぱり分からない。おまけに新しいアイデアもないので、最初はダルベッコのところで途中になっていたSV40を使った研究していました。けれども、ここには優秀な免疫学者が集まっているのだから、免疫学に関連したテーマを扱ってみようと思い始めたのです。そこで、テキストブックを読んだり所内の研究者に尋ねたりして、何か自分が挑戦出来る免疫学上の面白い問題はないかと探し始めました。そんな中でチャールズ・スタインバーグと知り合いになったのです。彼はマックス・デルブルックのもとで遺伝学を学んでおり、数学が出来てコンピュータのことも良く知っていました。ガールフレンド以外のことなら何でも聞いてくれと言わんばかりの秀才で。だからヤーネは、彼を参謀役として雇っていたらしいのです。そして僕がスタインバーグから聞いた面白い課題が、「抗体の多様性」という100年来未解決の大問題だったのです。
ご存知のように僕たちの体は免疫という防衛機能を備えていて、外部から進入した抗原となる病原体などを迎え撃ちます。まず迎え撃つのが、マクロファージや樹状細胞などが中心となって働く自然免疫。自然免疫は一度目の感染直後に働きますが、2度目の感染の際に素早く対応するのが獲得免疫。この獲得免疫で重要な働きをしているのが、B細胞が産出する抗体抗体とその模式図B細胞が産生するタンパク質であり、特定の抗原と結合する。血漿中に最も多い IgGなどはY字型をしており、2本ずつの軽鎖と重鎖からなる。軽鎖にはカッパ型とラムダ型があり、ラムダ型は変異が少ない。また、抗原と結合する先端部は多様な抗原と結合できるよう可変であり(V領域)、他の部分は共通性の高い不変領域(C領域)である。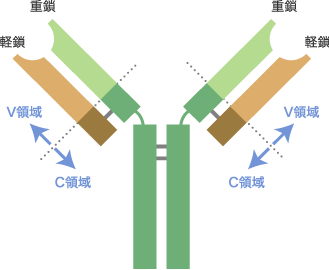 という一連のタンパク質群です。この抗体が細菌に結合すると細菌が破壊されたりマクロファージなどに補足されたりしますし、毒性物質に結合すると無毒化します。けれども一種類のB細胞は一種類の抗体しか作らず、一種類の抗体は一種類の抗原しか認識できない。だから、体外から進入するほぼ無限にある抗原に対して、数万個しかないヒトの遺伝子でどのように対応しているか、つまり抗体の多様性はどのように作りだされているのかという問いがあるわけです。これが免疫学者のメルビーン・コーンが名付けた大問題「Generation of diversity(多様性の発現)」、つまりGOD(神)のミステリーだったのです。
という一連のタンパク質群です。この抗体が細菌に結合すると細菌が破壊されたりマクロファージなどに補足されたりしますし、毒性物質に結合すると無毒化します。けれども一種類のB細胞は一種類の抗体しか作らず、一種類の抗体は一種類の抗原しか認識できない。だから、体外から進入するほぼ無限にある抗原に対して、数万個しかないヒトの遺伝子でどのように対応しているか、つまり抗体の多様性はどのように作りだされているのかという問いがあるわけです。これが免疫学者のメルビーン・コーンが名付けた大問題「Generation of diversity(多様性の発現)」、つまりGOD(神)のミステリーだったのです。
それを説明するために、当時2つの仮説がありました。一つは生殖細胞系列説と呼ばれるもので、精子や卵子の中に多様な抗体を生み出す遺伝的な情報が入っているとするもの。抗体以外のタンパク質についてはその遺伝情報は親から子へ受け継がれていることは分かっていましたから、タンパク質の一種である抗体もそれと同様のメカニズムだろうと予測されていたわけです。もう一つは体細胞系列説で、体細胞が発生分化していく過程で遺伝情報に変化が起こるというものです。造血幹細胞から分化したB細胞は、さらに抗体を産生する形質細胞に分化する過程で遺伝子上に変異が起きると考えたのです。当時、この2つの仮説を支持する研究者が2手に分かれて盛んに議論していたのだけれど、どちらも根拠となるデータが乏しくて決定的な結論には至らない。当時、多くの研究者は様々な抗体のアミノ酸配列から多様性の原理を導き出そうとしていましたが、アミノ酸配列は塩基配列に起因するわけですから、遺伝子を調べなければ結論が出ないことは僕には明らかでした。そこで分子生物学の手法で、この問題に決着を付けようと思ったわけです。

最初のアイデアは、DNA-RNAハイブリダイゼーションDNA-RNAハイブリダイゼーションB本来は2本鎖で存在するDNAを1本鎖にし、相補的なmRNAと結合させること。mRNAを放射性同位体で標識することで、結合を検出することが出来る。の速度から、B細胞の抗体に関わる遺伝子数を調べようというものでした。体細胞系列説であれば遺伝子数は少ないだろうから速度は速く、生殖細胞系列説であればそれより4桁以上遅いことになると計算できます。DNA-RNAハイブリダイゼーションのために、放射性同位体で標識したメッセンジャーRNA(mRNA)を作る必要があったので、まずはドイツのマックスプランク研究所を訪ね、骨髄にできるがん細胞・ミエローマミエローマ骨髄に発生する腫瘍。がん化によって特定の抗体を大量に生産するため、抗体あるいは抗体の遺伝子を集めるための材料となる。を手に入れるところから始めました。そしてハイブリダイゼーションの速度を測ったところ、抗体に関わる遺伝子数は少ないことがわかった。体細胞系列説を支持する結果です。当然、同じようなアイデアをもつ人はいたはずで、イギリスのアラン・ウィリアムソンとNIH(国立衛生研究所)のフィリップ・リーダーらが実験していました。ウィリアムソンらの結果は全く逆で、リーダーらの結果は僕らと大差なかったのですが解釈は逆でした。つまり両方とも、生殖細胞系列説を支持したのです。ウィリアムソンらの場合は、ミエローマから採ったmRNAの精製度が低かったからではないかと思います。僕はこの研究ではmRNAの精製が決め手になると予想し、徹底的に精製の操作を繰り返し98%まで純度を上げました。これが出来たのは、僕が化学出身でしかも物理化学的なトレーニングを受け、定量的な厳密さを常に心がけていたからです。
一方、リーダーらはかなり高純度のmRNAを使っていましたから、実験結果は大差なかったのですが解釈が逆だった。抗体には抗原と結合するための可変領域(V領域)がありますが、彼らはそこの変異が大きいためにmRNAは必ずしも全ての遺伝子に結合しないと考えたのです。その結果、遺伝子数がある程度少なくても生殖細胞系列説で説明できるとしたのです。これらの大御所と競争するのは大変ですねという同情の声もあったけれど、僕は少しもそうは思っていなかった。というのも、彼らの実験結果を聞いて、ますます僕の方が正しいと確信したからです。研究を進めていく時に大切なことは、いかに自分を納得させるかです。自分が納得できれば、相手を納得させるのは大したことではないと僕は思っています。そこで彼らとの論争に決着をつけるために、それまで使っていた抗体軽鎖上のカッパ型ではなく、変異が起こりにくいラムダ型を使い、それでも遺伝子数が少ないということを実証したのです。それと併行して行ったのがノーベル賞受賞の対象となった、細胞の分化過程で起こる遺伝子の再構成です。

主任研究者として在籍したスイスのバーゼル免疫学研究所。

親友のチャールズ・スタインバーグ(Charles Steinberg)博士と。(本人:右)
バーゼル免疫学研究所で、研究室のメンバーとディスカッションしているところ。(本人:左から4番目)

研究の合間に、スイスのグリンデルワルトのスキー場で。
ダーウィンの小宇宙
そのきっかけになったのは、ドライヤー・ベネット仮説でした。抗体の遺伝子には不変領域(C領域)をコードするC遺伝子一つとV領域をコードする多くのV遺伝子があって、発生過程で一つのV遺伝子が選び出されてC遺伝子と結合し、抗体の多様性を確保しているというのです。つまりバラバラだったCとVの遺伝子が、再構成によって、発生過程で一体化するという仮説です。この説をスタインバーグから聞いたとき、最初はそんなことあるわけがないと思いましたね。「一つの遺伝子が一つのタンパク質をコードしていて、発生過程では変化しない」という分子生物学の常識に反していたからです。そこで僕は、本当にそういうことが起こっているのか、起こっていたらどういうメカニズムなのかを確かめてやろうと思ったわけです。そこで、胎児マウスから採ったDNAと成熟マウスのミエローマから採ったDNAを比べて、CとVの遺伝子の位置を比べてみました。その際に使った主な技術が、標識したmRNAをプローブとしたDNA-RNAハイブリダイゼーション、DNAを特定の配列部位で切断する制限酵素、さらに電気泳動のゲルからDNAの断片を仕分けする方法でした。mRNA の3’末端側にはC遺伝子が、5’ 末端側にはV遺伝子がありますから、CとVの全体の領域を含んだmRNAと、3’末端側のCの領域だけを含んだmRNAをプローブとして使ったこともミソでした。そして、制限酵素で切断したマウス胎児からのDNAとミエローマのDNAに対して、この2種類のmRNAをハイブリダイゼーションさせたところ、胎児マウスのDNAはCとVがバラバラに存在し、ミエローマの場合は一体になっているという結果が出たのです。
その結果を見た日のことは今も忘れません。寒い冬の週末の朝、研究所にはほとんど人は居ませんでした。前日にガンマ線カウンターにセットした試料の結果を見て、めっぽう面白い結果が出てしまったなぁと思ったのを覚えています。こうして、造血幹細胞から生まれたB細胞が成熟していく過程で、再構成が起こって多様な抗体が生み出されていくメカニズムが明らかになったのです。つまり、遺伝子は進化の長い過程でしか変わらないという常識が、抗体の遺伝子には当てはまらないことが実証されたのです。ですからこれを、「Darwinian microcosms(ダーウィンの小宇宙)」と呼ぶ人もいます。これら一連の結果を得るまでには、
制限酵素の精製など多くの下準備が必要でしたから長い時間がかかりました。当初は2年だった契約を1年間延長してもらったのですが、結果が出始めたのはその任期も切れる直前だったのです。再度の延長は認められず、部屋の鍵と身分証を返却するよう要請されました。2ヶ月間給料も振り込まれない。でもその時はそんなことはおかまい無しに集中して実験していましたね。

その成果はバーゼル免疫学研究所所長のヤーネも認め、当時ジェームズ・ワトソンジェームズ・ワトソン【James Dewey Watson】(1928− )アメリカ出身の分子生物学者。核酸の分子構造および生体における情報伝達に対するその意義を明らかにした。これによってフランシス・クリックとモーリス・ウィルキンスと共に、1962年にノーベル生理学・医学賞を受賞。が所長をしていたコールド・スプリング・ハーバー研究所で発表できるようにしてくれました。1976年の夏です。素晴らしい成果が出ているという噂が広まって、大勢の研究者が詰めかけました。持ち時間は20分なのに、数多くの追試を積み重ねていたのでしゃべることが山ほどあり時間超過です。案の定、司会者に止められたのですが、ワトソンが「これは大事な発表だから途中で止めさせるな」と言ってくれた。発表が進むにしたがって会場が静まり返っていくのが感じられ、質疑応答も含めて全てが終ると大きな拍手がわき起こり、ヤーネとワトソンが寄ってきて「Congratulation」「Best talk」と褒めたたえてくれました。こんな気持ちの良い経験は初めてでしたね。この成果で1987年のノーベル生理学・医学賞を単独受賞したのです。アメリカでのビザが切れ、一時避難のつもりで移ったバーゼル免疫学研究所でしたが、この研究の成功もあって結局10年間在籍することになりました。最初は地下の階でテクニシャンと2人で始めた研究でしたが、上の階に移り研究所の5分の1の予算を使うまでに至りました。素晴らしい環境でしたが、やはり基礎研究の中心はアメリカだという気持ちがずっとあったので、1981年の9月マサチューセッツ工科大学(MIT)に教授として移ることにしました。東海岸のいくつかの大学から申し出があったのですが、ダルベッコの師匠にあたるサルバドール・ルリア教授サルバドール・ルリア【Salvador Edward Luria】(1912−1991)イタリアの微生物学者。バクテリオファージの複製増殖に関する機構を明らかにした。これによってマックス・デルブリュックとアルフレッド・ハーシーと共に、1969年にノーベル生理学・医学賞を受賞。がMITでがん研究所所長を務めていたこともあり、そこに移りました。

コールド・スプリング・ハーバー研究所のジェームズ・ワトソン(James Dewey Watson)所長と。(本人:左)

マサチューセッツ工科大学で行われたノーベル賞受賞の記者会見で、妻の真由美と長男の秀(ひで)と。(本人:右端)
ノーベル賞授賞式で訪れたストックホルムのアルフレッド・ノーベル(Alfred Bernhard Nobel)の銅像前で、妻の真由美と。(本人:右)

ノーベル賞授賞式で賞状とメダルをスウェーデンのグスタフ国王から受け取っているところ。(本人:左)
ノーベル賞発表後にマサチューセッツの自宅で、恩師・渡邊格先生と家族と。(本人:左端)
次のミステリーを求めて
MITに移ってからの最初の10年間は、T細胞の受容体に関わる研究や抗体遺伝子の発現調節に関わるテーマで研究を進めました。もちろん免疫学にも免疫寛容や臓器移植の際の拒絶反応の抑制など重要な問題がまだ多く残っていますが、それらは医学的なトレーニングを積み、患者のデータを扱える環境にいないと貢献するのが難しいと思いました。それに僕は、一つの分野で何十年も研究し続けて大御所と呼ばれるのを好まないので、1990年代前半からまだ大きなミステリーが残っている脳科学に移ったのです。特に、記憶に関心があります。記憶は非常に奥深い現象で、記憶がその人を作っていると言っても良いくらいです。人は生きていく中で様々なことを経験し、経験から特定の情報を抽出して脳の中に溜み、それに基づいて次の行動するわけです。それぞれの人の記憶の歴史が違うから、それぞれの人が違うのです。もちろん遺伝子の違いもありますが。つまりあなたの記憶は、あなたそのものなんです。記憶なしだったら、あなたはあなたになってはいない。

具体的に研究を始めるきっかけには、1991年にアルシノ・シルバと言う若者が僕の研究室にやってきて心の現象を研究したいと言ったことでした。すでに僕たちは免疫研究でノックアウトマウスを使っていましたから、それを用いて記憶の解明に挑んでみようということになったのです。記憶には短期記憶と長期記憶があり、長期記憶はさらに技術記憶(procedural memory)と陳述記憶(declarative memory)に分類されます。技術記憶は運動などが上達していく際に得られるもので、そのとき筋肉をどう動かしているかなど説明できません。一方の陳述記憶は、言葉を使って述べることが出来るもので、僕たちは陳述記憶に焦点を絞りました。海馬のスライスを用いた先行研究で、カルモジュリンキナーゼⅡ(α-CaMKⅡ)という酵素の阻害剤を加えると、記憶の長期増強(LTP:Long Term Potentiation)が阻害されることが分かっていました。そこで僕たちは、α-CaMKⅡ遺伝子のノックアウトマウスを作り、LTPが空間的な情報の記憶に必要であることを実証したのです。行動を伴った記憶の検証には個体を用いた実験が欠かせません。ですから、僕たちが脳科学分野で初めて使ったノックアウトマウスという手法は画期的なものと言えます。けれども、この時に用いたのは体のすべての細胞で特定の遺伝子を除くグローバルノックアウト法でしたから、発生過程で様々な影響が出ている可能性がありました。しかも脳は部位によって機能が異なりますから、時間的・空間的に特定の細胞での遺伝子をノックアウトする技術、つまり部位局限的ノックアウト法を開発する必要がありました。そのとき使ったのが、Cre-loxPCre-loxPシステムとその模式図Creという酵素によってloxPという短い配列が認識され、loxPで挟まれた遺伝子のみを除くことが出来る。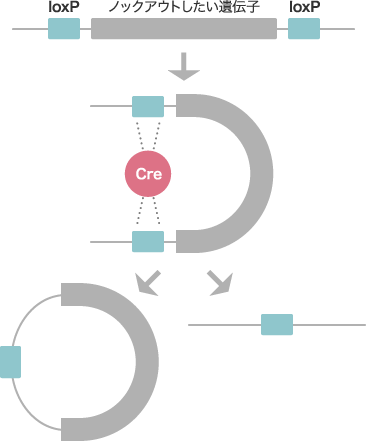 というシステムです。
というシステムです。
Cre-loxPシステムは、バクテリオファージで見いだされた部位特異的にDNAを組換える方法で、Creという酵素によってloxPという短い配列が認識されます。ノックアウトしたい遺伝子の前後にloxPを挿入した細胞で、Creをある時間に特定の細胞で発現させ、部位特異的にその遺伝子を除くのです。最初に僕たちがターゲットにしたのは、海馬海馬とその模式図大脳辺縁系の一部であり、主に記憶や学習に関わる。海馬に入ってきた信号は、まず歯状回に入り、CA3を経てCA1に伝わる。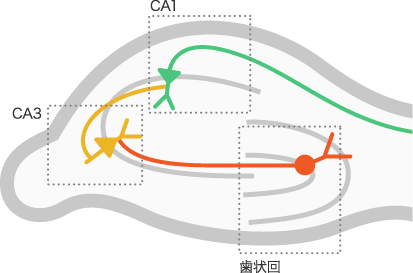 にあるCA1野のNMDA受容体でした。海馬に入ってきた信号はまず歯状回と呼ばれる領域に入り、CA3野を経てCA1野へと流れます。このCA1野には記憶のLTPに関わる受容体がいくつかありますが、NMDA受容体はLTPの記憶以外ではあまり使われないことが分かっています。ですから、CA1野だけでNMDA受容体をノックアウトすると、LTPに関わるシナプス伝達だけに影響が出るはずです。そこで、NMDA受容体のサブユニットの一つNR1をCre-loxPシステムでノックアウトし、マウスの長期記憶に関わる行動を調べてみました。マウスの行動を定量的に調べるために使った一つの方法が、モリス水迷路です。直径約1.5メートルのプールに白濁の液体を満たし、マウスをそこに放すのです。マウスは疲れてもフチからは上がれません。しかし、一カ所だけ水面下に1センチ程度の台がありそこで休むことが出来ます。水迷路を置いた部屋の数カ所に標識を付けておくと、その情報からマウスは水面下の台の位置を記憶します。ランダムに泳いでいるマウスは、台を探しだすのに1分ほどかかるのですが、20回ほど実験を繰り返すと15秒ほどで台に辿り着きます。けれどもCA1野のNMDA受容体をノックアウトしたマウスは、ランダムに泳ぎ回るばかりで台を探し出す時間は短縮しませんでした。つまり、CA1のNMDA受容体に関わる一つの遺伝子がはたらかないと、空間的な記憶が獲得できないことが分かったのです。
にあるCA1野のNMDA受容体でした。海馬に入ってきた信号はまず歯状回と呼ばれる領域に入り、CA3野を経てCA1野へと流れます。このCA1野には記憶のLTPに関わる受容体がいくつかありますが、NMDA受容体はLTPの記憶以外ではあまり使われないことが分かっています。ですから、CA1野だけでNMDA受容体をノックアウトすると、LTPに関わるシナプス伝達だけに影響が出るはずです。そこで、NMDA受容体のサブユニットの一つNR1をCre-loxPシステムでノックアウトし、マウスの長期記憶に関わる行動を調べてみました。マウスの行動を定量的に調べるために使った一つの方法が、モリス水迷路です。直径約1.5メートルのプールに白濁の液体を満たし、マウスをそこに放すのです。マウスは疲れてもフチからは上がれません。しかし、一カ所だけ水面下に1センチ程度の台がありそこで休むことが出来ます。水迷路を置いた部屋の数カ所に標識を付けておくと、その情報からマウスは水面下の台の位置を記憶します。ランダムに泳いでいるマウスは、台を探しだすのに1分ほどかかるのですが、20回ほど実験を繰り返すと15秒ほどで台に辿り着きます。けれどもCA1野のNMDA受容体をノックアウトしたマウスは、ランダムに泳ぎ回るばかりで台を探し出す時間は短縮しませんでした。つまり、CA1のNMDA受容体に関わる一つの遺伝子がはたらかないと、空間的な記憶が獲得できないことが分かったのです。

次に、CA3野でこの遺伝子をノックアウトしたところ違った結果になりました。空間的な記憶の獲得には支障がないのですが、水迷路の周りの標識をいくつか取り除いて位置情報を減らすと、台を見つける時間が短縮しないのです。僕たちは、面と向かって話したことのある人のことを、声だけから思い出せますよね。つまり、限られた情報から記憶を想起する、パターン・コンプリーションという能力をもっているのです。マウスもこの能力を備えているのですが、CA3野でNMDA受容体に関わる一つの遺伝子をノックアウトしたマウスではこの能力に欠陥が見られました。CA3野のニューロンはCA3に対してシナプスを形成している、いわゆる反回経路を作っており、それがこの能力に関わっていることは古くからデイビット・マーなどの理論家が提唱していましたが、僕たちはそれを実証したのです。
1990年に米国議会が脳の10年を決議し、1994年にMITにも学習・記憶研究センターが設立され、初代センター長に就任。(本人:左から2人目)
記憶の再構成
ここ数年間は記憶を作りだすことに挑んでいます。過誤(かご)記憶つまり間違った記憶をマウスの脳内に作りだすことに成功し、2013年『Science』に発表しました。アメリカでは、目撃証言によって被告とされた人のうち、実に75%もの人が無罪だったという統計があります。脳は断片的な記憶を集めて過去を再構築しますが、その時に多くの人が再構築の仕方を間違えているのです。けれども、どのようにして過誤記憶が形成されるのかは不明です。そこで僕たちは、マウスに過誤記憶を作れるかどうか試しました。化学では組成不明な新しい物質があると、まずその物資を形成している分子の種類や相対的な数量を分析し、次にそれを実際に合成して、できた物質が元の物質と同じ性質を持っていることを証明しなくてはなりませんが、あたかも実体がないように思える記憶に関しても、同様の手続きを踏む必要があるのです。
実験では、特定の記憶を保存している脳細胞を同定して、光を照射すると、その細胞のみが活性化して、保存されていた記憶が再生される遺伝子組み換えマウスを作りました。まず、マウスを安全なAの箱に入れ、その箱の環境を記憶させておきます。この記憶を担っている細胞に、光に対する感受性を与えるチャネル・ロドプシンというたんぱく質を導入しておきます。その後、そのマウスをBの箱に移し、光刺激を与えてA箱の記憶を思い出させると同時に、マウスに恐怖感を与える電気刺激(ショック)を足に与えます。そのようにして、Aの環境と恐怖記憶を関連付けたのです。そうするとマウスは、その後Aの環境に戻したときも恐怖を示すようになりました。さらに、マウスが全く別の環境にいるときも、光刺激を与えてショックの記憶を再生させることによって恐怖を示すようになったのです。つまりあるショックの記憶と環境記憶という別々に体験したことが、記憶上結びついたのです。この研究を進めるために使ったのが、すでに2012年『Nature』に発表していたオプトジェネティックス(光遺伝学)という手法を使った記憶細胞群の同定と、任意による記憶再生の証明でした。具体的には2段階の仕掛けがあって、1つはニューロンが活性化したときにだけ発現する転写活性化因子の遺伝子をDNA上に組み込んだこと。2つ目は、その活性化因子の発現によって、光に応答するチャネル・ロドプシンという膜タンパク質が発現するようにしたことです。これによって、学習の際に活性化したニューロンだけを、光を使って自在に再活性化できるようにしたのです。つまり、記憶が特定の細胞に保存され、それを任意に取り出すことができることをわれわれが証明したのです。

ヒトの場合もある経験と別の経験が関連付けられ、過誤記憶が作りだされています。ヒトは極めて高度なイメージ力をもった生きものですから、他の生きものよりもこの傾向が強いと僕は予想しています。もちろん現時点では、はっきりした答えはありませんが、過誤記憶はヒトの創造性と深い関係があると考えているのです。高い創造性は他の生きものにはおそらく備わっておらず、ヒトが進化の過程で獲得したものです。現実の世界とイメージした世界を組み合わせることによって、ヒトは芸術や科学を創造してきました。この背後には、高いイメージする能力の副産物として過誤記憶が起こるのではないだろうかと僕は考えているのです。

記憶に関わる研究を進めているMIT・ピカワ学習記憶研究所で。
毎年恒例の自宅裏庭でおこっているサマー・クックアウトで、研究室のメンバーと。
生涯、科学者でありたい
17世紀のフランスの哲学者ルネ・デカルトは心と体は別物であるという二元論の立場をとりましたが、紀元前500年頃に生きた「医学の父」と呼ばれるヒポクラテスは心にまつわる感情などの現象も脳から生み出されると述べています。そしてヒポクラテスの言葉を現代的に述べたのが、ワトソンと共にDNAの2重らせん構造を発見したフランシス・クリックです。彼は『The astonishing hypothesis(驚くべき仮説)』という本の中で、感情や自己のアイデンティティーも、膨大な数の神経細胞とそれに関連する分子の振る舞いなのだと述べています。僕もこの仮説の正しさを確信していますし、この立場に立って記憶に関わる現象を科学的に解明したいと考えています。今からおよそ40年前にGODのミステリーを解く幸運を手にしたわけですが、次は記憶という現象を分子の言葉で語るために生涯、科学者であり続けたいと思っています。僕はいつも「次の研究」、つまり未来に最も関心があるのです。