遺伝学との出会い
1929年に大阪市内の商家(楽器商)に生まれました。淀屋橋の南、四ツ橋の北、今の靭(うつぼ)公園から南に当ります。6人兄弟の2番目でしたが、長男が早く亡くなったため、実質は長男として育ちました。小学校6年生の時に太平洋戦争が始まり、楽器は贅沢品と見られて廃業、郊外の豊中に移ったんですね。それまでは生きものに接する機会がほとんどなかったのですが、豊中に移ってからは、食生活を支えるためにも家庭菜園を手伝うようになり、植物に親しみを持ち始めました。
終戦の翌年の1946年春、両親は一旦故郷の京都丹波へ帰農することになり、私は三重農林専門学校(現在の三重大学農学部)に入学しました。外地から引き揚げてきた人が多く、ほとんどが年上でしたね。幸い、学校があった津市は京都や大阪より食料事情が良く、農業実習のおかげもあって健康的な3年間を過ごしました。植物学を中心に農学を一通り習う中で、特に遺伝と育種に興味をもちました。さらに遺伝学を学びたいと考えて、小麦遺伝学の大家である木原均先生(京都大学名誉教授、元国立遺伝学研究所所長、故人)が居られた京都大学農学部の農林生物学科に1949年の春に入学したんです。

幼少の頃。同居していた父方の祖母(能楽の師匠)に厳しく躾けられ、その影響を受けた。

靫(うつぼ)小学校の頃。

同じく小学校の頃に、弟の清と。(本人:右)

旧制高津中学校の頃。配属将校による教練、軍需工場への勤労動員、空襲による学校の全焼などを経験した。

三重農林専門学校(現在の三重大学農学部)の頃に、学校の正門前にて(1946年)。
木原均先生の研究室で
当時の農林生物学科は、植物病理学、応用昆虫学、応用植物学、そして木原先生が居られた実験遺伝学の4講座で、学生も毎年12〜13人ほどでした。小さい学科なので必須科目が少なく、他の学科や理学部の植物学科、動物学科、生化学教室などの講義を聴きに出かけられる自由で開放的な雰囲気でした。最も印象深かったのは、入学直後の木原先生の講義です。1年前にスウェーデンのストックホルムで開催された戦後初の国際遺伝学会で聞いて来られた話をされました。戦時中は、Nature誌などの学術雑誌はもちろん、海外からの情報はほとんど入って来ませんでしたから貴重な講義でしたね。木原先生はまず、遺伝学では戦時中に非常に大きな変化があったとおっしゃった。遺伝学の本質的な問題を解くために、ショウジョウバエ、小麦、トウモロコシなどの高等生物を使うのではなく、微生物を研究材料として用いる研究が米国を中心に急速に広まったというのです。微生物遺伝学です。最初に使われたのはアカパンカビ、それからバクテリア、そしてバクテリアに感染するバクテリオファージ。例えば、一遺伝子一酵素仮説の提唱者として有名なジョージ・W・ビードルとエドワード・L・テータムは、アカパンカビを使って遺伝子が細胞内の個々の生化学反応を制御していることを実証しました。彼らはこの業績によって、1958年にノーベル生理学・医学賞を受賞しましたね。この講義で、遺伝学の世界では非常に重要な進展があったという興奮がひしひしと伝わってきました。特に印象に残ったのは、微生物は構造が単純でしかも世代交代の時間が短く、たくさんの個体を一定の環境で培養でき、遺伝子の実体や働きを明らかにしていくには適した生きものだということ。講義室に掛けられた手書きの解説図を今でも鮮明に覚えています。
この講義を聞いた私達は興奮して、13人いた同期生のうち6人が実験遺伝学講座を希望しました。講座配属後も小麦を選んだのは一人だけで、他の5人は微生物を対象に卒業研究をしたいと申し出ました。専門外でしたから、木原先生や他のスタッフも大変だったでしょうね。当時、農学部テニスコートの横に長い温室があって、その端に温室の世話をする園庭さんの部屋がありました。そこに小さな無菌室を作ってもらって実験を始めたんです。それまで小麦の種の発芽に使っていたシャーレを借り、植物病理学講座の先輩に無菌操作を習って、5人がそれぞれ思い思いの微生物を使って実験を始めました。同期の小関治男くん(京都大学名誉教授、故人)は鞭毛虫の仲間・ミドリムシ、私は青カビを研究対象にしました。抗生物質ペニシリンを産生するペニシリウム属のカビです。青カビは糸状菌ですから、菌糸という多数の細胞から成る糸状の構造をつくります。同じ系統内、あるいは異なる系統の菌糸間でも頻繁に細胞の融合が起こり、一つの細胞の中に複数系統の細胞核を含む状態になります。これをヘテロカリオン(異核共存体)といいますが、その菌糸から胞子が作られる時には、そのうち唯一個の核が胞子の中へ入っていきます。当時、英国のグイド・ポンテコルボらが疑似有性生殖サイクルとして研究課題にしていた現象です。その現象が、当時木原先生が興味をもって居られた細胞小器官に由来する遺伝、つまり細胞質遺伝を調べる手段になり得るんじゃないかと私は考えたわけですね。

研究を進めるにあたって、東京大学農学部の青カビの専門家・有馬啓先生(故人)に教えを請いに行き、そのついでに京都大学では見つからなかった文献を東京大学の図書館に探しに行ったり。当時はコピー機などありませんから手書きで写しましてね。学部の2年間に手探りでやった研究ですから成果は甚だ心許ないものでしたが、この卒業研究がきっかけになって、微生物を材料にして遺伝子の機能を中心とする生きものの生理的・生化学的な動的な面を、探求したいという気持ちが固まりました。後になって考えると、自由に研究させて下さった木原先生は、大変な気苦労だったと想像しますけれど。

京都大学農学部農林生物学科の1回生の頃(1949年)。
農林生物学科25期生の卒業コンパにて(1952年)。(本人:前列右から2人目、小関治男くん:中列右から3人目)
コールドスプリングハーバーに渡り
卒業後1年間は特別研究生として在籍しましたが、その年(1953年)の秋から米国コールドスプリングハーバーにあるカーネギー遺伝学研究所(現在のコールドスプリングハーバー研究所)に留学することになりました。春に、木原先生が所長のミリスラフ・デメレッツ博士(故人)を訪問されたことがきっかけでした。その年は、ジェームズ・D・ワトソンとフランシス・H・C・クリックがDNAの2重らせん構造モデルを発表した年です。横浜から出航した貨物船で12日間かけてサンフランシスコに入港し、さらに大陸横断列車で2日半かけて研究所があるニューヨーク州ロングアイランドに向かいました。日本から持ち出しが許可されたのは確か現金30ドル。期待と緊張に満ちた旅でした。
ワトソンが所長になって以来のコールドスプリングハーバー研究所は大規模になりましたが、当時は20〜30人の所員しかいない小さい研究所でした。でも、植物のトランスポゾンを発見したバーバラ・マクリントック、T2ファージの遺伝物質がDNAであることを発見したアルフレッド・D・ハーシーなど優秀な研究者がいたのです。毎夏ここで開かれるシンポジウムは、遺伝学者の間では良く知られていて、バクテリアとバクテリオファージの研究者の交流の場としても中核的な存在になっていました。
デメレッツ先生はとても温厚で、本来ショウジョウバエの遺伝学者なのに、60歳を過ぎてからサルモネラ菌の遺伝学を始めたんです。私が留学した頃は、ノートン・ジンダーとジョシュア・レダーバーグが発表した形質導入法を用いて、サルモネラ菌遺伝子の微細構造を解析し始めていました。突然変異を起こして栄養要求株を作り、それにバクテリオファージを感染させる。

そこで増殖したファージは、宿主菌のゲノムDNAの一部を取り込んでいるわけです。そのファージを、表現型が同じ別の変異株に感染させる。すると、全く同じ部位の突然変異であれば組み換えは起こりませんが、少しでもずれていると組み換えを起こします。その組み換え率は、変異を起こした部位のゲノム上の位置が近いほど低くなる。それを指標にして、サルモネラ菌の栄養要求性に関わる殆どの遺伝子の微細構造を決定していったんですね。
こうして、一つの遺伝子の変異、すなわち同じ栄養素を要求し、同じ化学反応に欠陥をもつ変異株の間でも、殆どの場合低い頻度ながら組み換えが起きることを示しました。トリプトファンを例にとると、その生合成過程で働く数個の酵素の遺伝子は、染色体上で非常に近い位置にある。しかもトリプトファン合成段階で酵素が働く順番と、酵素に対応する遺伝子の並ぶ順番が同じだった。非常な驚きでした。これら一連の研究からデメレッツ先生は、ショウジョウバエの研究成果から提唱してきた疑似対立遺伝子という概念、つまり一つの遺伝子の中に変異や組み換えを起こすたくさんの部位があることを、サルモネラ菌を使って具体的に実証したのです。私も、DNAやRNAの構成要素であるプリン塩基とピリミジン塩基の要求株を使ってこれを解析しました。一方で私は、プリン要求株からプリンがなくても生育する復帰変異株には、完全に親株と同じ生育を示すものの他に部分的な復帰変異株があること、それらはプリンを合成する酵素とは別のサプレッサー遺伝子の突然変異によって起こることを見つけました。その結果をコールドスプリングハーバーのファージ講習会で話したことで、多くの研究者と知り合えました。
このように研究は順調に進んだのですが、遺伝子の機能を調べるためには、やはり生化学的な知識と技術が必要であると渡米前から感じていました。そこで、イエール大学からサマースチューデントとして来ていた女性に連絡を取ってもらい、イエール大学のデイビット・ボナー先生(故人)を訪ねました。推薦状も無しで乗り込んでいって直談判したんです。するとボナー先生は、2つ返事で許可してくれました。ただし、大学院に入学するには全国テストを受けなければいかんと。そこで生物学と簡単な数学、そして英語の試験を受け、1955年の2月からイエール大学に移りました。結局、コールドスプリングハーバーに居たのは1年3ヶ月。デメレッツ所長には無理をお願いして、後任には小関治男くんが来ることになりました。
米国カーネギー遺伝学研究所(現在のコールドスプリングハーバー研究所) のミリスラフ・デメレッツ(Milislav Demerec)所長の研究室にて(1953年)。(本人:手前)
緑豊かなニューヘイブンで
イエール大学があるニューヘイブンは、ニューヨークから汽車で約2時間の緑豊かな落ち着いた大学町で、ボナー先生の研究室は医学部の微生物学教室内にありました。私は京都大学での履修科目の関係で植物学専攻の院生として入学し、植物学教室があるオズボーン・ラボラトリーの塔にルームメイトと3人で一緒に住みました。大学院教育はとても充実しており、日本との違いにカルチャーショックを受けました。講義では予備知識がなくても学問の系譜と最新の情報が分かるよう整理されたプリントが配られ、半世紀以上も前のグレゴール・J・メンデルが書いた論文を読む機会も与えられました。正統な基礎をしっかり把握することの重要性を徹底的に教え込まれたわけです。これは、私のその後の研究と教育に対する考え方に強い影響を与えました。
ボナー先生は、ビードル、テータムらと一緒にアカパンカビの遺伝生化学を進めてきた一人ですが、当時はトリプトファン合成酵素に注目して、遺伝子が酵素の合成や特異性の決定にどう関わるかを研究していました。その中で私は、ヘンリー・J・ヴォーゲル博士に直接の指導を受け、アカパンカビのプロリン生合成の最終段階で働く酵素探しを始めました。幸い、早い段階で酵素の活性を見出し、ピロリン-5-カルボン酸レダクターゼと命名しました。加えて、新しい酵素も見つけ、その過程で酵素の検出、精製、特徴調べの生化学的手法を習得しました。さらに、ピロリン-5-カルボン酸レダクターゼの活性を欠く変異株の遺伝子解析も進め、結局2年半で博士号を取得出来ました。ボナー先生の研究室は自由闊達で温かい雰囲気に包まれていましたし、そこでの研究生活は格別の充実感がありましたね。実は、イエール大学に移って間もない1955年夏、その後の帰国のきっかけを作って下さった渡邊格先生(慶應義塾大学名誉教授、故人)と初めてお会いしています。
当時、渡邊先生はカリフォルニアに滞在していらして、コールドスプリングハーバーにT2ファージ研究で有名なハーシーを訪ねられたのです。私と入れ違いでカーネギー遺伝学研究所にいた小関くんが、それで渡邊先生のご家族を案内してニューヘイブンを訪ねて来たんです。私がルームメイトと一緒に使っていた古い車を夜通し走らせて、ナイアガラの滝を見に行きました。その時に初めて、渡邊先生から京都大学のウイルス研究所の話を聞きました。当時、渡邊先生は東京大学理工学研究所の教授で、ウイルス研究所を兼任されていました。「自分は東大を辞めて、京大のウイルス研に移ろうと思う」とおっしゃり、自分は物理化学が専門なので、バクテリオファージを扱える遺伝学の専門家が欲しいということでした。
ボナー先生からそろそろ次のことを考えたらどうかとも言われていましたので、1957年夏に博士号取得後、ちょうど東京で開かれる国際酵素化学シンポジウムに出席することにしました。4年ぶりの帰国です。一度帰国して考える機会を持てたのは、有り難いことでしたね。2〜3か月の特別有給休暇をもらい、京都の友人達と久しぶりに話しましたし、またウイルス研究所の天野重安所長(故人)を訪ねて状況を伺いました。結局、直ぐには帰国せずに、2年間ボナー先生のところの博士研究員として研究することになりましたが。
その後の2年間は、自分で見つけたピロリン-5-カルボン酸レダクターゼの遺伝子変異と活性の関係を研究しました。遺伝子変異によって酵素活性が低下するのですが、それは酵素の発現量が下がるのではなく、酵素の性質(活性化エネルギーや熱安定性)の変化によることが分かったのです。この成果を「Proceedings of the National Academy of Sciences (PNAS)誌」に発表しました。当時は、クリックがセントラルドグマ説を提唱した頃で、一遺伝子が一酵素の働きを支配しているとは考えられていましたが、まだ遺伝子が酵素の性質を決定していることの確証は充分ではなかった時代です。それをはっきりさせたかったのです。
この頃、アカパンカビを用いて発展してきた遺伝子機構の研究は、バクテリアとバクテリオファージを用いた研究に急速に変わっていきました。バクテリアの遺伝子解析法とタンパク質や核酸の生理的・生化学的研究が急速に進んだからです。遺伝暗号の解読や遺伝子とタンパク質の一次構造上の対応関係などの研究が本格的に進みだした頃でもありました。ですから、サルモネラ菌から離れた私も、再びバクテリアを研究対象にしようと思いました。そして渡邊先生とのご縁で、京都大学ウイルス研究所に移ることになったんです。けれども、帰国後は研究テーマと共に、研究費をどうするかということも大きな問題でした。その頃の日本の研究環境は今からは想像できないほど貧しかったので、必要な機器をそろえるには外国の研究費に頼らざるを得ません。ボナー先生とデメレッツ所長にも相談に乗っていただき、ロックフェラー財団からの支援が受けられました。渡邊先生も努力されて、アメリカ国立衛生研究所(NIH: National Institutes of Health)から研究費を受けることができました。

米国イエール大学医学部のデイビット・ボナー(David Bonner)先生の研究室にて(1955年)。
100ドルで購入した1949年製シボレーの前で、共同所有者の高野義郎(現・横浜国立大学名誉教授)さんと(1955年)。高野さんは湯川秀樹先生の教室の出身者で、この車には湯川先生も乗車された。(本人:左)
ナイアガラの滝を観に行ったとき、シボレーを背にして(1955年)。(左から、小関治男くん、渡邊格先生とそのご家族)
小関治男くんらとフロリダへドライブ旅行(1955年)。(本人:右)

米国マサチューセッツ州のプリマスにて(1955年)。ここは、英国の清教徒・ピルグリムファザーズが、メーフラワー号で最初に上陸した地。
米国ニューヘイブン郊外のボナー先生宅で結婚披露パーティーを開いて頂いた(1957年)。(左から、ボナー夫人、本人、妻の昌子、ボナー先生)
結婚披露パーティーにて家内と私が余興として楽器を演奏した(1957年)。(本人:バイオリン、家内:ピアノ)
博士号授与式の日に、アカデミックローブを纏って(1957年)。(右写真の本人:左)
米国セントルイスで開かれた米国細菌学会にて(1957年)。ボナー先生の一番弟子のチャールス・ヤノフスキー (Charles Yanofsky)博士(テーブル手前の右) の受賞を祝う同窓会。(本人:テーブル向こう左から3番目、ボナー先生:テーブルの左端)
京都大学ウイルス研究所に移り
帰国した1960年、渡邊先生が教授だったウイルス研究所の化学部は、少し前にNIHから帰国された早石修先生(現・京都大学名誉教授、現・財団法人大阪バイオサイエンス研究所名誉所長)の医化学教室の一部を間借りしていました。東京大学理工学研究所から来られた助教授の木方行郎さん(元・農水省植物ウイルス研究所、故人)、大阪大学の赤堀四郎先生(大阪大学名誉教授、元・大阪大学総長、故人)の教室出身の助手・春名一郎さん(大阪大学名誉教授、故人)が居られました。その前には、渡邊先生と一緒に東大から三浦謹一郎さん(東京大学名誉教授、故人)が来て居られたのですが、入れ替わりで米国のコロンビア大学に留学されました。
その頃は、渡邊先生を先頭に木方さんと春名さんが中心になって、T2ファージの感染初期に作られるRNAとタンパク質の研究をしていました。分子生物学初期の重要なテーマです。数年後、形質導入法を確立したジンダーがRNAファージを発見しました。渡邊先生がその論文を読み、「これだ。これを日本でも探そう」ということになったんです。そこで京都市の保健所へ出かけ、いろいろな場所で集めた土などをもらってきてRNAファージを探したんです。私も手伝いました。こうして見つかったのが、一本鎖RNAをもつQβファージです。
ジャコブとモノーがオペロン説を発表して間もない1960年代初頭、日本でもようやく分子生物学が始まった頃です。渡邊先生は分子生物学を盛んにしたいと強く考えておられ、もちろん私達も出来るだけの協力をしました。ですから、ウイルス研の化学部は分子生物学の拠点の一つとして国内外の研究者が出入りし、非常に活気に満ちていましたね。各地で不定期に開かれたインフォーマルな研究会に加えて、富澤純一先生(現・国立遺伝学研究所名誉教授)が、第一回ファージ講習会を金沢大学医学部で開かれるなど、分子生物学の機運は次第に盛り上がって行きました。
一方で、既存の生物学や生化学の研究者からは、分子生物学はなかなか理解してもらえなかった。理解者は、以前から本格的に核酸研究を進めておられた江上不二夫先生(東京大学名誉教授、元・三菱化成生命科学研究所名誉所長、故人)や柴谷篤弘先生(元・京都精華大学学長、故人)、少し若いところでは大澤省三さん(現・名古屋大学および広島大学名誉教授、元・JT生命誌研究館顧問)、高浪満さん(現・京都大学名誉教授)くらいでしたね。生化学者の早石先生とトイレで一緒になったとき、「生化学と分子生物学はどう違うんですかね」と率直に質問されました。「分子生物学では、遺伝や増殖に興味をもつ研究者が多いですね」と答えましたが。無理もありません。Molecular Biologyという言葉が出来たのは1960年頃で、Journal of molecular biologyという雑誌が創刊されたのは1959年、日本の分子生物学会が発足したのはそれから約20年後の1978年です。
京都大学ウイルス研究所化学部のメンバー(1961年)。(本人:後列左から5人目、渡邊格先生:後列左から4人目、木方行郎さん:後列左から3人目、春名一郎さん:後列左から7人目)

放射線影響学会での特別講演(1961年)。
ハワイのホノルルでの日米科学会議にて(1965年)。日米の著名な科学者が出席した。例えば、最前列の最右には、形質導入法を開発したノートン・ジンダー (Norton Zinder)博士が。(本人:最後列の最左)
新設の遺伝学部門で
帰国3年後の1963年、渡邊先生が慶應義塾大学医学部に移られました。何人かのスタッフも一緒に異動しましたが、高価な機器はほとんど置いていかれたので非常に助かりましたね。その年に、初めて正規の大学院生として利根川進くん(現・マサチューセッツ工科大学教授、現・理化学研究所脳科学総合研究センター長、現・理研-MIT神経回路遺伝学研究センター長、現・ハワードヒューズ医学研究所主任研究者)がやってきたのですが、渡邊先生が異動されることもあって、カリフォルニア大学サンディエゴ校に行ったんです。かつてイエール大学で私の恩師だったボナー先生のところです。
渡邊先生の後任は、早石研の杉野幸夫博士(元・武田薬品工業(株)中央研究所所長)でした。杉野グループは、デオキシリボヌクレオチドリン酸化キナーゼの研究をしていました。助教授になった私は、大阪大学医学部遺伝学教室(吉川秀男教授)から来た平賀壮太さん(元・熊本大学発生医学研究所教授)、院生の伊藤維昭さん(現・京都大学名誉教授、元・京都産業大学教授)と一緒に、トリプトファンオペロンの制御機構の研究を始めました。トリプトファンはタンパク質の必須成分ですが、培地中のトリプトファン濃度を一定以上にすると、リプレッサーによってトリプトファン合成酵素の遺伝子発現が抑制されます。濃度を下げると、抑制が解除されてトリプトファン合成酵素が作られ、細胞内でトリプトファンができる。そういうトリプトファンオペロンの発現制御に関わる調節遺伝子の発見や調節機構の研究をしていました。

1968年には遺伝学部門が新設され、そこの教授になりました。それを機に、遺伝子の転写とDNA複製の制御を部門の研究テーマに掲げました。けれども大学紛争が吹き荒れ、研究はストップし、人事も滞る状態がしばらく続いたのです。アルバートアインシュタイン大学でRNAポリメラーゼの研究をしていた石浜明さん(現・国立遺伝学研究所名誉教授)を助手として、DNA複製分野で活躍していた永田俊夫さん(元・京都大学助教授)をハーバード大学から助教授として迎え、新しい態勢が整ったのは結局1970年の春でした。その後、助手となった伊藤維昭さんが細胞膜形成の研究を始め、平賀さんと和田千恵子さん(現・株式会社吉田生物研究所)がそれぞれ独自の系を使ってプラスミド複製の研究を進め、何人かの院生が加わって本格的な研究が漸く動き出しました。それ以来、1993年の退官までの研究成果の中で、最も大きく発展したのが熱ショック応答です。
ウイルス研究所遺伝学部の教授室にて(1970年)。
熱ショック応答との出会い
熱ショック応答は、1962年、イタリアの遺伝学者フェルチョ・リトッサがショウジョウバエで最初に見出した現象です。幼虫の飼育温度を通常の25度から37度に上げ30分間ほどすると、唾腺染色体の幾つかの部分がパフという膨らんだ構造になることを見出したのです。パフは発生過程でも特異的に現れる現象で、当時からmRNAの合成との関係が考えられていました。1974年、アルフレッド・ティシエらが、放射性アミノ酸でタンパク質を標識する方法と当時開発されたばかりのSDSポリアクリルアミドゲル電気泳動を使い、熱ショックに伴って合成が誘導されるタンパク質の挙動を解析したのです。後に熱ショックタンパク質(HSP: Heat shock protein)熱ショックタンパク質(HSP: Heat shock protein)
熱ショックなどのストレスによって、発現が上昇するタンパク質の総称。多くは、タンパク質がフォールディングする際に、その介添え役(シャペロン)タンパク質として働く。
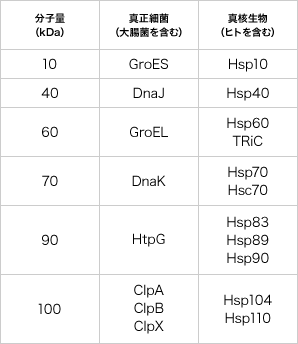
と総称されるタンパク質です。
その後、酵母や哺乳類の細胞で、そして私達は大腸菌で、また少し遅れて植物でも熱ショック応答が確認されました。1980年代になると、大腸菌と酵母、ショウジョウバエの間でHSPのアミノ酸配列が非常に似ており、進化の過程で広く保存されているという注目すべき事実が分かって来ました。それらが広く注目を集め、1982年夏、コールドスプリングハーバーで、熱ショック応答に関する初めての国際会議が開かれ、私も招待されました。以来、例えば分子量が60kDaあるいは70kDaのHSPは、それぞれHSP60あるいはHSP70と呼ばれ、代表的な HSPあるいはシャペロンタンパク質(註1を参照)として大腸菌のGroELあるいはDnaKなどが取り上げられ、詳細な研究が展開されてきました。
私達のグループが大腸菌の熱ショック応答に行き当たった背景には、1960年代後半から始めたRNAポリメラーゼRNAポリメラーゼ鋳型となるDNAの塩基配列を読みとって、mRNAを合成する酵素。大腸菌のRNAポリメラーゼは、2分子のαサブユニットと1分子ずつのβ、β’、σ、ωサブユニットから成る。σサブユニット(σ因子)はRNAポリメラーゼを特定のDNA配列に導く役割を担い、その他のサブユニット複合体はmRNAを合成するコア酵素として働く。特に、rpoH遺伝子から合成されたσ32は、HSP発現のためのプロモーター部位にRNAポリメラーゼを導く。
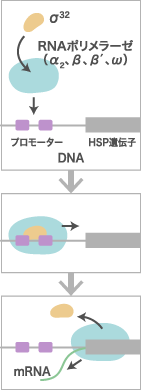 に関する研究があり、また幾つかの”幸運な偶然”の積み重ねがあったんです。当時その酵素が2分子のα、それぞれ1分子のβ、β’、σ(シグマ)、ωのサブユニットを含む複合蛋白質であることは分かっていましたが、それらの遺伝子は見つかっておらず、またこの酵素が細胞内で実際RNA合成に働いているという確証もありませんでした。そこで、RNA合成酵素に結合してその働きを阻害する、当時見つかったばかりの抗生物質(ストレプトバリシン、リファンピシンなど)を用いて、その耐性変異株を分離しその性質を調べました。まず見つかったのがβサブユニットの遺伝子、その後そのすぐ近くにあるβ’遺伝子も特定しました。離れた場所にあるαサブユニットは、リボソーム研究で有名な野村眞康さん(元・カリフォルニア大学教授)がリボソーム関連遺伝子群の中に見つけました。そして最後に転写の特異性を決める重要なσサブユニットも院生の中村義一くん(現・東京大学名誉教授)が染色体の色んな領域を組み込んだF’プラスミドのセットを巧みに使って決めました。
に関する研究があり、また幾つかの”幸運な偶然”の積み重ねがあったんです。当時その酵素が2分子のα、それぞれ1分子のβ、β’、σ(シグマ)、ωのサブユニットを含む複合蛋白質であることは分かっていましたが、それらの遺伝子は見つかっておらず、またこの酵素が細胞内で実際RNA合成に働いているという確証もありませんでした。そこで、RNA合成酵素に結合してその働きを阻害する、当時見つかったばかりの抗生物質(ストレプトバリシン、リファンピシンなど)を用いて、その耐性変異株を分離しその性質を調べました。まず見つかったのがβサブユニットの遺伝子、その後そのすぐ近くにあるβ’遺伝子も特定しました。離れた場所にあるαサブユニットは、リボソーム研究で有名な野村眞康さん(元・カリフォルニア大学教授)がリボソーム関連遺伝子群の中に見つけました。そして最後に転写の特異性を決める重要なσサブユニットも院生の中村義一くん(現・東京大学名誉教授)が染色体の色んな領域を組み込んだF’プラスミドのセットを巧みに使って決めました。
遺伝子の同定と平行して細胞内でのRNAポリメラーゼの機能解析を進めたわけですが、その場合重要な方法は、薬剤耐性と同時に温度感受性(高温で増殖出来ない)となった変異体を多数分離して色んな表現型の変化を調べることでした。その一つが院生の山森哲雄くん(現・基礎生物学研究所教授)がやっていたポリメラーゼ変異による鞭毛形成の変化です。彼がその時コントロールとして使った野生型の大腸菌の培養温度を低温(30℃)から高温(42℃)に急激に上げると、5分以内に一時的に合成速度が約10倍高くなる数個のタンパク質があることを放射性同位元素でラベルしたタンパクを一次元のSDSゲル電気泳動で調べることによって見つけたんです。
その後中村君が色んな変異体を同様に高温シフトして作られるタンパク質をラベルしてRNAポリメラーゼに特異的な抗体によって沈殿してくるタンパク質をSDSゲル電気泳動にかけて各サブユニットの合成速度の変化を調べていると、既知のサブユニット以外に正体不明のピークが現れ、それがすべての株で常に高温シフト後約5分で極大となることを見つけました。しかもそのタンパクが山森君の見つけていた数個のタンパク質の中の一つと同じであることが判りました。それが、ATP分解活性をもつGroELだったのです。なぜこの時にGroELが見つかったかというと、それはRNAポリメラーゼと結合しやすく、抗体作成に使うために精製したポリメラーゼに少量混入していたんですね。この幸運なハプニングによって、GroELが熱ショックで強く誘導されることが分かったんです。

加えて、伊藤維昭さんがGroELのナンセンス変異株を分離したという文献を読んでいて、どうも腑に落ちないことがあって、早速変異株を取り寄せて調べたところ、GroELの他に2つのHSPも同時に熱による誘導が見られないことが分かりました。この発見は大きかったですね。その変異遺伝子は、特定のHSPの遺伝子ではなく、複数のHSPの合成に関わる調節(制御)遺伝子である可能性が出てきたんですから。この変異株には、高温ではナンセンス変異を翻訳出来なくなるサプレッサーtRNAがありましたので、その株にサプレッサー効率の異なる色々なtRNAを作らせて調べると、作られてくるHSPの合成量はサプレッサーtRNAの働く効率に比例していました。つまり、このナンセンス変異を起こした遺伝子は熱ショック応答の正の調節遺伝子で、その産物である調節タンパク質の量に応じてHSPの合成量が増えることが分かったのです。それが1980 年頃。これは面白くなりそうだと腰を落ち着けて取り組むことにしました。
ところで当時、私達はあえて熱ショックという言葉を使いませんでした。ショウジョウバエで見つかっていた現象とは、近いけれども少し違うのではないかと考えていたんですね。けれども、偶然1980年に私の部屋を訪ねてきたシドニー・ブレナー博士(現・米国ソーク研究所特別研究教授)に二次元電気泳動のデータを見せたところ、「これは大腸菌の熱ショックだ」って言ったんです。当時、彼がいた英国王立医学研究院で熱ショックを研究している人のデータとそっくりだったんです。ですから、今でも彼に会うと、「大腸菌の熱ショックを見つけたのは君だ」って言ってるんですね。
コロラド大学の末岡登教授を訪ね、留学中の山森哲雄くんと3人でロッキー山脈の方へ出かけて(1982年)。
ウイルス研究所の談話室にて、最後の院生、松永くんと(1993年)。
熱ショック応答の機構に迫る
さて、熱ショック応答の正の調節に関わる転写因子として、私達が新たに見つけ出したのがrpoH遺伝子です。その後にrpoH遺伝子の産物σ32が見つかりました。今では、熱ショックによってσ32の合成量が増加し、それと結合したRNAポリメラーゼが様々なHSP遺伝子のプロモーターに結合し、HSPの合成を促進することが分かっています。前にもお話したように、私達はrpoH遺伝子に変異が入ると、HSPが誘導されないという現象を見つけたわけですから、当然その遺伝子をクローニングして配列を決めるわけですね。しかし、当時は現在のようなシーケンス技術は発達していませんから、研究室の誰もやりたがらなかった。幸い、当時カリフォルニア大学の野村眞康さんのところで、伊藤維昭さんが解析技術を習ってきたので、私が教えてもらって自分ですることにしました。「教授でも、ちゃんと放射性物質を使うためのテストを受けて下さいね」と伊藤さんに言われて、学内のテストを受けて配列を決定しました。それが1983年頃。ちょうど同じ頃、ウイスコンシン大学のキャロル・グロス博士(現・カリフォルニア大学サンフランシスコ校)らが、別の研究から見つけたσ32(大腸菌では2番目のシグマ因子として発見された)が、奇しくもrpoH遺伝子の産物であることが1984年頃に分かったのです。それから彼女らと、共同研究などを含む密接な交流が始まりました。
rpoH遺伝子についてはそれと並行して、欠失株も含む新しい変異株の分離、プロモーターの探索、さらに熱ショックにより誘導されるHSP、特にGroELとDnaKの高温での増殖における重要性など、幾つかの新しい事実が出てきました。次いで、京都とウイスコンシン大学で熱ショック応答の制御機構を、それぞれrpoH遺伝子とσ32の側から明らかにしてゆく過程で、σ32の合成、分解、活性の3つの側面を分けて解析を進めました。合成に関しては、1990年頃に院生の永井宏樹くん(現・大阪大学微生物病研究所准教授)が、rpoH遺伝子の2つの領域(翻訳開始点に近いA領域と少し下流のB領域)が重要ということを見出しました。低温ではmRNA上の2つの領域に当たる塩基配列の間で対合が起こり、二次構造が形成され、翻訳開始点が隠されてリボソームが結合出来なくなります。一方、高温では二次構造がほどけて発現が増大することを見つけました。それは、σ32の合成の制御がmRNAの転写ではなく、翻訳の段階で起こるというグロス研の結果とも一致しました。この問題は、その後これらの領域に塩基置換や欠失を入れてその効果を調べるなど検討を重ね、さらに私の定年後も、株式会社エイチ・エス・ピー研究所(HSP研究所)で詳細な解析を続けました。そして最終的に、様々な塩基置換をもつmRNAの物理化学的な性質(CDスペクトル)やmRNAとリボソームの結合の温度依存性を比較し、それらが細胞を使って観察されるσ32発現の温度依存性と良く一致することを森田美代さん(現・名古屋大学大学院生命農学研究科教授)が大阪大学蛋白質研究所の旧京極(好生)研究室との共同研究によって明らかにしました。これらの結果によって、mRNAの二次構造形成とその融解による翻訳制御というモデルを直接証明することが出来ました。つまり、特定のタンパク質ではなく、rpoH遺伝子のmRNAが温度センサーとして働くことが分かったのです。この様な翻訳制御機構は、HSP研究所の中東憲二さん(現・慶応義塾大学先端生命科学研究所特命准教授)が大腸菌以外のグラム陰性菌で見つけたσ32ホモログの塩基配列の解析結果などから、かなり広く見られることが分かりました。けれども面白いことに、植物細胞内で増殖するアグロバクテリアでは、熱ショックをかけると、σ32の合成の誘導は見られず、その活性のみが増大します。
大腸菌のσ32のもう一つの特徴は、低温での半減期はわずか1分と、細胞内で極端に不安定なことです。この分解には、膜タンパク質と細胞質内タンパク質の両方の分解に関わる、内膜に局在しているATP依存性プロテアーゼ(FtsH)が働くことを、小椋光さん(現・熊本大学発生医学研究所教授)、秋山芳展さん(現・京都大学ウイルス研究所教授)、金森正明さん(現・金沢大学理工研究領域講師)、さらに独国ハイデルベルグ大学のベルンド・ブカウ博士が1990年代後半の研究から明らかにしました。一方で、低温では大腸菌内に10〜30分子程度しかないσ32が、高温に移すと急激に10〜20倍に増量されます。この増量には、σ32の翻訳の誘導と共に一時的な安定化も関わります。金森さんやブカウ博士らの結果によると、このσ32の安定化と分解の調節には、σ32の高次構造の変化も密接に関わっているようです。
さて、熱ショック応答が誘導された後には、いわゆる’適応期(回復期)’が現れます。一旦急増したσ32は徐々に減少し、その結果HSPの合成も失速し、やがて低温より少し高い定常状態に達するのです。この時期の制御つまり負のフィードバック制御は、タンパク質の恒常性を維持するために、細菌から動物、植物、ヒトに至るまで普遍的に見られる重要な機構です。けれども、その実態は今でも良く分かっていません。大腸菌では1990年代からDnaK/JやGroEL/SなどのHSPがその制御に関わることが知られていましたから、熱ショックによって過剰に蓄積したDnaK/JやGroEL/Sがσ32に結合し、その結果σ32とRNA ポリメラーゼとの結合が拮抗阻害されて不活性化し、FtsHによって分解されるという単純なモデルが最近まで信じられていました。精製したσ32を用いてHSP遺伝子の転写を開始する活性を調べると、確かにDnaKによって阻害されました。けれども一方で、精製したFtsHのタンパク質分解活性は低く、HSPによる活性の上昇も観察出来なかったのです。
このような状況で、サンフランシスコに移ったグロス研に滞在して研究を続けていた私は、σ32の負のフィードバック制御がHSPによる拮抗阻害だけでは説明できないことをはっきり示しました。その時に私が分離した制御不全変異株は、先に金森さんらが安定性を指標に分離していたσ32の変異と全く同じ領域(領域2.1)の変異株だったのです。ですから、領域2.1がσ32の安定性とフィードバック制御の両方に関与していることは明らかでした。そして当初の期待とは異なり、負のフィードバック制御がかからない変異株から精製したσ32は、HSPとの結合能力においても、またHSPによる活性阻害においても、野生型のσ32とほとんど変わらないことが分かりました。2007年に私が第一著者として発表したこれらの結果は、負のフィードバック制御には未知の因子や制御回路が関与している可能性を示すものだったのです(PNASに掲載)。
そこで、これまでとは違った方法で、新しい制御不全変異株を探しました。その結果得られたのが、シグナル認識粒子(SRP: Signal Recognition Particle)の受容体(SR: SRP Receptor)が減少することによって負のフィードバック制御がかからなくなった変異株でした。これは全く予想外のことでした。SRPとSRは、大腸菌でもタンパク質の膜への移行や組込みに関わる因子として1990年代から知られていました。そこで先ず、新しく見つかった変異株の示す制御の異常が、SRの減少によって膜外に取り残された不特定のタンパク質による二次的な熱ショック制御異常ではなく、σ32が直接SRP/SRに結合する可能性を探るため、増殖中の細胞内でσ32がSRP、SRと複合体を作るかどうかを調べました。すると、確かに3者の複合体が見つかりました。さらにグロス研の院生ベントリー・リムくんが、精製したσ32と精製したSRP、SRとの結合を調べたところ、σ32はSRPとのみ特異的に結合し、SRとは複合体を作らないことが分かりました。一方で、領域2.1の制御不全変異株から精製したσ32は、SRP とほとんど結合しないという驚くべき結果も出てきたのです。

この間に私は、京都大学の秋山研究室(旧伊藤研究室)から膜透過孔として働くタンパク質SecYの変異株一式を貰って、σ32の制御機能の変化を調べ、σ32の制御にはSecYのSR結合機能やタンパク質の膜移行機能が関わることを見つけました。その後、京都に戻ってからもグロス研との共同研究を数年間続け、2013年末にσ32を中心とする制御回路を示す第一報の論文(PLoS Biologyに掲載)が出ました。その回路というのは、まずσ32がSRPと結合し、それが膜上のSRに移動し、さらにSecYとSecE、Gの複合体であるSecYEG透過孔の働きによって内膜表面(FtsHの近くかもしれない)に到達するというものです。この回路でσ32が膜に移行することが、σ32の不活化と分解を助けることは容易に理解出来ます。それと同時に、σ32の膜への移行は、細胞質と膜という2つの空間におけるタンパク質の品質管理を統合あるいは調整する意味をもつのではないかと考えています。
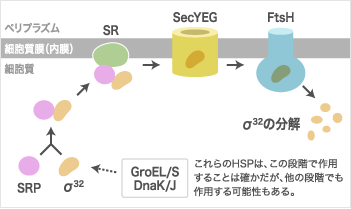
熱ショック応答の負のフィードバック制御回路
このように熱ショック応答の制御の全く新しい制御回路が見つかり、少し展望が開けてきましたが、その制御回路の実態については未だ殆ど分かっていません。例えば、膜タンパク質の場合に考えられているように、リボソーム上で合成途上のσ32のN末端ペプチド鎖が翻訳の進行と同時に、SRPの助けを借りて膜へ移行してゆくのか、それとも翻訳が終わって完成したσ32が状況に応じて膜移行するのか、またDnaK/JやGroEL/Sがどの段階で働くのかなども分かっていません。これらを含めて今後さらに踏み込んだ解析が待たれます。当面は、秋山研で院生の宮崎くんが進めつつあるσ32とSRPの相互作用の具体的な分子機構、σ32の制御領域(領域2.1)の役割などが一層明らかになっていくことを期待しています。
加えて、熱ショック応答の研究は確かに高温という「ストレス」を対象に始まりましたが、その結果現在分かりつつあることは、単にストレスに対する応答に留まらず、実は生物にとって最も基本的で重要な「恒常性の維持」(ホメオステイシス)の理解を深めることになるということです。このことは熱に限らず、ストレス応答全般について言えることですが、特にタンパク質の折りたたみを助ける主要なシャペロンの発現を厳密に制御する熱ショック応答の場合に顕著なことと言えそうです。ですから、その意義は限りなく広く深いものを含んでおり、HSPの機能面の研究と共に、将来大きく発展する可能性を秘めていると考えています。

株式会社エイチ・エス・ピー(HSP)研究所にて(2000年)。
コールドスプリングハーバーで開いてもらった退職記念集会にて(2000年)。(本人:前列左から4人目、主催者のリチャード・モリモト(Richard I. Morimoto)教授:前列左から3人目、キャロル・グロス(Carol A. Gross)教授:前列左から5人目)
今でも共同研究を続けている、カリフォルニア大学サンフランシスコ校のキャロル・グロス教授の研究室にて(2009年)。
同じくキャロル・グロス教授の研究室にて、メンバーと(2009年)。
実験科学者として
これら熱ショック応答に関わる一連の研究を進める中で、京都大学を退官し、官民共同出資のHSP研究所を立ち上げました。1993〜2000年の7年の期限付きで、HSPの基礎と応用にまたがる研究を続けました。所員は20名程でしたが、大腸菌からヒトまで幅広い分野の研究者が集まって研究を進め、特に基礎研究では大きい成果を上げました。大腸菌以外の細菌でもσ32ホモログの分布範囲、その構造と機能、制御の系統的な広がりや相違点など多くの有用な知見を中東憲治さん(現・慶應義塾大学大学院政策メディア研究科准教授)が明らかにしました。より高等な生物では、特に森和俊さん(現・京都大学大学院理学研究科教授)と吉田秀郎さん(現・兵庫県立大学教授)のグループが、酵母と動物細胞を使って、小胞体ストレス応答の制御機構に関する重要な研究を進め、引き続き京都大学での長年の成果と合わせて、最近大きな賞を取りましたね。私にとってもここでの7年間は、大学とは一味違う環境で、研究資金の申請や報告書の準備すら、製薬会社から出向の研究部長が主に担当され、私は研究面と論文作成に専念出来るという素晴らしい経験でした。実験をやらなかったのが、今から考えると残念だったようにも思いますが。
HSP研究所が終って、2001年にスイスにいたGroELの発見者コスタ・ジョーゴプロス博士のところで3ヶ月間、博士研究員として招待を受け、少々実験させてもらいました。家内と一緒にアルプスの山歩きも楽しみながら。今では誰でも使っているポリメラーゼ連鎖反応(PCR)用の機械を使ったのもその時が初めてでした。その時に思ったんですね。自分はまだ実験やれるんじゃないかと。それから13年の歳月が流れましたけれど、今も京都産業大学(千葉志信准教授の研究室)の研究員として暗夜帰路の日々ですよ。やはり私がたずさわっているのは実験科学ですから、中々実験から離れられないのが実状です。実験して手を動かすことがボケ防止になるとか、新しいことが見つかると止められんようになるというのもありましょうが(笑)。でもやはり私にとって一番幸せなことは、好きなことをさせて頂けるこういう場があるということですね。感謝あるのみです。

現在も、京都産業大学の総合生命科学部(千葉志信准教授の教室)で、客員研究員として、大腸菌の熱ショック応答に関わる研究を続けている。
瑞宝中綬賞叙勲を祝って、仲間が「囲む会」を催してくれた(2009年)。花束を持って家内と。
囲む会に参加してくれた仲間(2009年)。(左から、岩倉洋一郎さん、平賀壮太さん、家内、中村義一さん)
囲む会に参加してくれた仲間と談笑中(2009年)。(左から、本人、永田和宏さん、和田千恵子さん)
囲む会の2次会にて(2009年)。(左から、伊藤維昭さん、本人、小椋光さん)
囲む会にて、旧HSP研究所のメンバーと(2009年)。(本人:最前列右から2人目、柳秀樹研究部長:最前列右から1人目、森和俊さん:2列目右から3人目)
囲む会には、海外からも含めて、総勢58名もの仲間が出席してくれた(2009年)。(本人:中央で花束を持って)





























