年度別活動報告
年度別活動報告書:2010年度
脊索動物と節足動物の共通祖先を理解する 2−1 オオヒメグモの胚発生を支配する分子メカニズムの解明
小田広樹(主任研究員) 秋山-小田康子(奨励研究員)
野田彰子(研究補助員)
西口茂孝、金山真紀(大阪大学大学院生)
はじめに
多細胞動物は形態や発生様式に基づいて動物門と呼ばれる高次分類群に分類されているが、形態が変化してきた経緯や仕組みを理解することは簡単ではない。私たちヒトを含む脊椎動物は、無脊椎動物のホヤやナメクジウオとともに、より高次の分類群である脊索動物門にまとめられている。このグループに共通する重要な形態形質は脊索と呼ばれる体の中心を貫く組織であるが、この組織が進化の歴史の中でどこから、どのように由来したのかは定かではない。一方、ハエやチョウなどの昆虫は、エビやクモなどの非昆虫とともに節足動物門にまとめられている。このグループに共通する形態のひとつは繰り返し構造をもつ外骨格であるが、この繰り返し構造もどのように由来したのかは定かではない。脊索動物の脊索も節足動物の外骨格も機能性の高い構造物であるために、それぞれのグループの中ではしっかりと保守されてきたようである。このような形態進化の保守的側面は形態に基づいて分類することを正当化する一方で、保守性を打ち破るような歴史的大変化を見抜き、理解することを難しくしている。それでも、ゲノムに基づく比較研究はこの困難を克服する可能性を秘めている。形態はあくまでもゲノムを介し、発生プログラムとして次世代に継承される。ゲノムの情報がどのように進化し、その進化が形態の進化とどのような関係にあったかを理解する努力が、生物の歴史を偏見無く、客観的に理解するために求められている。
本研究はゲノムの進化と形態の進化の関係を分析し、その関係の中に普遍性を見出すことを長期的な目標としている。私たちは、そのために最も有効なアプローチとして、脊索動物門と節足動物門を軸とした比較学を展開している。節足動物門を研究対象にすることの最大のメリットは、優れたモデル生物である双翅目昆虫のキイロショウジョウバエを活用できることである。しかし、これまでの研究が昆虫類に大きく偏って研究が展開しているために、節足動物の進化の初期に存在した形質を推測するための手がかりは非常に乏しい。私たちはこのような状況を打開していくために、これまでに鋏角類のオオヒメグモ (Achaearanea tepidariorum) を新しいモデル生物として開拓し、世界に先駆けて、節足動物の初期進化に関する新たな知見を見出してきた。それらを簡単にまとめると、同じ節足動物のハエとクモでは形態的には類似していても、ゲノムに保持されている発生プログラムには予想以上に大きな違いがあることが分かった1)。なかでも、クモ胚での初期パターン形成におけるヘッジホッグシグナルの役割には注目すべき違いがある。クモ胚のヘッジホッグシグナルは、前後軸の形成及び背腹軸の向きの決定に主要な役割を果たす2)。それに対して、ハエ胚のヘッジホッグシグナルは体節形成の最終段階(体節の極性形成)になるまで必要とされない3)。ハエ胚の前後軸形成ではヘッジホッグシグナルの代わりに転写因子のビコイドが、背腹軸の向きの決定では卵形成におけるガーケンシグナルが、中心的な役割を果たしている4), 5)。ここで注意すべきは、ビコイドもガーケンも非常に限られた範囲の昆虫にしか存在しない点である5), 6)。広く多細胞動物に保存されているヘッジホッグとは対照的である。ショウジョウバエに向かった進化の過程で発生プログラムが大きく変容した可能性が高い。このことは発生プログラムの進化的不安定性を意味し、比較学によって過去の変化を正確に追跡することが困難なのではないかという危惧をもたらす。しかし、節足動物門の外に眼を向けると、オオヒメグモにおいて明らかになった仕組みがハエよりも脊椎動物の仕組みに似ている例が見つかる1)。このことは、もしかすると、動物門の間の変化(または違い)は意外に小さく、ある程度の追跡は可能であることを意味するかもしれない。しかし、現段階で確実に言えることは、高次のグループ間の関係を理解するためには、まず各グループ内における発生プログラムの違いをしっかりと把握しなければならないことである。
私たちはこのような立場に立って、オオヒメグモを用いた発生メカニズムの解明に徹底して取り組み、節足動物門内の多様性を議論するための土台を作りたいと考えている。本年度は、昨年度までに確立したマイクロインジェクションを活用して7)、胚における遺伝子機能の解析方法やライブイメージングの方法を確立した。さらに、クモの頭部領域の体節形成において波のように振る舞う遺伝子発現を明らかにするとともに、その振る舞いを制御する仕組みの一端を明らかにした。これらの結果から、ハエとクモの体節形成の違いについて新しい知見が得られた。
結果と考察
(1)胚性RNA干渉法 (embryonic RNA interference [eRNAi]) の確立
オオヒメグモ胚での遺伝子機能の解析はこれまでparental RNAi (pRNAi)に頼ってきた8)。この方法は、雌親の体腔内に標的遺伝子の二本鎖RNA (dsRNA) を繰り返し注射すると、その個体から産生されたすべての卵においてRNAiによる効果(標的遺伝子の発現抑制)が得られるというものである。pRNAiは簡便であるだけでなく、一度に多数の卵で効果が得られるために非常に有用である。しかし、デメリットもある。例えば、標的遺伝子の働きが親個体の生存や卵形成に必要な場合は目的の卵を得ることができない。また、卵が得られても初期の胚発生が正常に進まなかったり、胚全体で複合的に異常が現れたりするような場合、注目する現象において標的遺伝子の働きを解析することができないこともある。これらのデメリットを克服するひとつの方法として、マイクロインジェクション法を使って初期胚の細胞に直接dsRNAを導入する方法がある。この方法はembryonic RNA interference (eRNAi) と呼ばれる。そこで、実際にこの方法をオオヒメグモでの遺伝子機能の解析に適用できるのかを試した。
図1には、スムースンドのホモログに対して作製したdsRNAを32-64細胞期胚の割球にマイクロインジェクションを行った例を示す。スムースンドはヘッジホッグシグナルを細胞内部に伝達するために必須の膜蛋白質である。スムースンドdsRNAが導入された細胞を追跡できるようにするために、蛍光デキストランを混ぜてマイクロインジェクションを行った。その結果、胚帯形成期の初期まで発生させると、多くの胚で標識された領域に腫瘍が形成され、ヘッジホッグmRNAの発現パターンにも影響が現れた。一方、クラゲ蛍光タンパク質に対して作製したdsRNAのマイクロインジェクションでは腫瘍形成も、ヘッジホッグの発現パターンの異常も観察されなかった。スムースンドdsRNAによる効果が遺伝子特異的に現れているかどうかをさらに検証するために、最初のdsRNAとは重複しない領域からスムースンドdsRNAを作製し、マイクロインジェクションを行ったところ、最初のdsRNAと同様の異常が生じた。さらに、他のいくつかの遺伝子に関して同様にdsRNAのマイクロインジェクションを行ったところ、遺伝子によって異なる表現型が現れることを確認した。そして、それらの表現型はpRNAiの結果と矛盾しなかった。また、dsRNAが導入された領域において標的遺伝子の発現の低下もmRNAレベルで確認された。以上の結果から、オオヒメグモ胚でもeRNAiによる遺伝子機能の解析が可能であることが明らかになった。
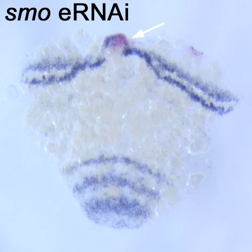
図1. スムースンドeRNAi胚でのヘッジホッグの発現パターン. dsRNAが導入された領域に腫瘍ができている(矢印)
(2)蛍光タンパク質を用いた細胞運動のライブ観察
オオヒメグモの胚発生ではパターン形成とともに細胞が非常にダイナミックに運動する。遺伝子発現と細胞運動との関係を正確に把握することは、発生メカニズムを理解するために重要である。そこで私たちはマイクロインジェクションを用いて、核移行シグナル (NLS) と蛍光タンパク質の融合蛋白質をコードするmRNAを胚の細胞に導入することによって、蛍光タンパク質を胚の一部で発現させた。蛍光タンパク質には、GFPの他にmCherryやtdEosFPを試した。これらのうち、とりわけ、NLS-tdEosFPは蛍光が強く、長時間にわたって十分なレベルの蛍光が観察された。さらに便利なことに、tdEosFPはもともと緑色の蛍光を発する蛋白質であるが、紫外線の照射によって赤色の蛍光を発するように変換させることができる(光変換と呼ぶ)。この光変換を利用すると、生きた胚での細胞運動や細胞分裂の追跡が容易になる。図2には、NLS-tdEosFPをオオヒメグモ胚の細胞に発現させ、それらの細胞の一部に紫外線を照射して光変換を行った例を示す。3次元のタイムラプス観察によって、細胞の動きと増殖の様子を把握することができた。オオヒメグモ胚の予定頭部領域の上皮細胞では、細胞が腹側正中線の方向に移動し、細胞間への割り込み運動(インターカレーション)をすることによって組織が全体として前後に伸長している様子(収斂伸長と呼ぶ)が観察された。また、ビオチンと連結したデキストランをmRNAとともにマイクロインジェクションすることによって、ライブ観察直後に固定したサンプルにおいても、その観察した領域を抗体染色で同定することができた。このような実験手法を取ることにより、細胞の動きや分裂と遺伝子発現との関係をある程度解析することができることが分かった。
次に、核移行シグナルの代わりにヒストンタンパク質を蛍光タンパク質に融合して胚細胞に発現させることによって、分裂期の染色体を可視化し、分裂パターンを詳しく解析できないかと考えた。しかし、この試みは主に以下の2つのことが原因で実現していない。ひとつは、ヒストンタンパク質の種類にもよるが、細胞の生存や分裂頻度にネガティブな影響(毒性)が表れたこと、ふたつめは、毒性がほとんど見られない場合でも、検出される蛍光が発生の進行とともにかなり弱くなってしまったことである。核移行シグナルとヒストン以外にもいくつかのタンパク質を試したが、NLS-tdEosFPほど有用性の高いコンストラクトを作製することに成功していない。細胞運動を記述するにあたり細胞境界の可視化は必須である。今後も試行錯誤を続けていく必要がある。

図2. NLS-tdEosFPを発現させた胚. 一部に紫外線を照射して光変換を行った.左のパネルは緑色の蛍光を、右は赤色の蛍光を検出したもの
(3)オオヒメグモの頭部体節形成における遺伝子発現のダイナミクス
昨年度までの解析と今年度さらに詳細に行った遺伝子発現パターンの解析により、オオヒメグモの頭部の体節形成においてヘッジホッグの発現が一本の縞として胚盤の縁から後方へ移動した後にその縞が二つの縞に分かれ、そのうち前側の縞がさらに二つに分かれることが明らかになった。第一の分裂で生じる縞が触肢の体節に、第二の分裂で生じる縞が鋏角の体節に相当した。(2)で述べたように、ヘッジホッグの発現パターンがダイナミックに変化する過程では細胞もダイナミックに再配列運動をし、組織としては収斂伸長を行う。細胞追跡と胚染色を組み合わせた解析によって、ヘッジホッグの遺伝子発現が進行波のようにダイナミックに移動し、その縞パターンが分裂波のように挙動することを示すことができた。
オオヒメグモのオルソデンティクルの発現領域は、ヘッジホッグの発現領域と胚盤の縁や移動中の縞、分裂中の縞で重なっていた。これまでの研究でオルソデンティクルの発現がヘッジホッグシグナルに支配されていることを明らかにしていたが、今年度、オルソデンティクルに対するeRNAiを行い、オルソデンティクルの機能がヘッジホッグの発現制御に果たす役割を調べた。その結果、オルソデンティクルは胚盤の縁ではヘッジホッグの縞が移動を開始するのに必要であり、その後の予定頭部外胚葉では移動中のヘッジホッグの縞状の発現を維持するのに必要であることが分かった。これらの発見に加えてさらに興味深かったのは、左右に分かれたヘッジホッグの縞がそれぞれ独立に分裂したことである。つまり、その縞の分裂パターンには縞の大きさに合わせてパターンを自己調整する能力があることが示唆された。この現象はクモの胚発生の調節性を裏付けるものであり、今後さらに踏み込んで解析する価値がある。
昨年度に報告したマイクロアレイ解析で、ヘッジホッグシグナルの標的遺伝子の候補としてショウジョウバエのペアールール遺伝子オッドペアードのホモログが同定された。この遺伝子の機能に関しては以前からpRNAiを用いて解析を行ってきたが、今年度さらにeRNAiを用いた解析によって、オッドペアードがヘッジホッグの縞パターンの分裂に必須の役割を果たしていることが確認された。オッドペアードはヘッジホッグの縞を分裂させる際に、その縞の内部にヘッジホッグネガティブな領域を生み出すのに関わっていると考えられた。
以上のように、オルソデンティクルとオッドペアードは初期の発現がヘッジホッグシグナルに支配された遺伝子であるが、その一方で、これらの遺伝子はヘッジホッグの発現をそれぞれ正に、または負に制御していることが判明した。ヘッジホッグシグナル経路はそれ自体でフィードバック制御機構を備えていることが知られているが、クモの予定頭部外胚葉ではそのシグナル経路に、体節形成特異的な正と負のフィードバック制御因子が組み込まれ、ヘッジホッグの縞の移動と分裂が実現していると推測される。遺伝子発現の進行波のような挙動は多くの例が知られているが、分裂波と見なせる挙動についてはほとんど記載がない。
今回明らかにしたオオヒメグモの体節形成の様式は「分裂式付加型」と言える。この様式は、ショウジョウバエの胴体部で知られている、すべての体節が同時に形成される「同時形成型」や、同じ付加型であっても、脊椎動物の体節形成で知られている振動性の遺伝子活性化によって縞パターンを発生させる様式「振動式付加型」とも明確に異なる。ここで注目すべきは、オオヒメグモの頭部で「分裂」によって体節を生み出す仕組みが、ショウジョウバエの頭部や胴体の体節形成の仕組みと重要な成分を共有している点である。遺伝子ネットワークの構造を変化させることで体節形成の様式を多様化させたことが示唆される。遺伝子発現パターンの観察から、オオヒメグモの胸部と後体部では頭部と異なる体節形成の仕組みがあることも推察される。今後、このオオヒメグモの体節形成をモデルとして、数理生物学も取り入れながら、パターンを生み出すための基本原理を探究するとともに、パターンの多様化を支配する根源的な仕組みを解明したいと考えている。
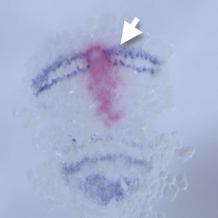
図3. オルソデンティクルeRNAi胚でのヘッジホッグの発現パターン. dsRNAが導入された領域でヘッジホッグの発現が消失している(矢印)
(4)背腹軸の向きを決める細胞運動におけるヘッジホッグシグナルの役割の解明
私たちは2010年の論文で、ヘッジホッグシグナルがオオヒメグモ胚において前後軸の形成だけでなく、背腹軸の向きの決定に重要な役割を果たすことを報告した2)。その論文の中で、ヘッジホッグのレセプターであり、負の制御因子として働くパッチトの機能をpRNAiによって抑制すると、背側領域(胚外組織)を誘導するクムルス間充織細胞(CM細胞と呼ぶ)の、極領域から赤道領域への移動が妨げられ、前後軸と同じ向きに背腹軸が形成されることを示した。しかし、パッチトの機能がCM細胞の移動にどのように関わっているのかについては十分な理解が得られていなかった。例えば、pRNAiによる遺伝子機能の抑制効果は胚の中のすべての細胞で表れうるために、パッチトの活性がCM細胞で必要なのか、それとも、胚盤の細胞で必要なのか、また、その両者で必要なのかは不明のままであった。そこで、本年度、eRNAiを用いて、胚盤の局所領域でパッチトの機能を抑制した場合にCM細胞の移動に影響が及ぶかどうかを調べた。その結果、パッチトdsRNAが導入された領域にCM細胞がとどまり、そこで胚外組織が誘導されるケースが多数観察された。これらの観察は、パッチトの活性が少なくとも胚盤細胞側で必要であることを示唆した。さらに、胚染色を組み合わせた解析から、パッチトの機能が抑制された領域またはその近傍で、胚盤の縁領域のマーカーであるオルソデンティクルの発現が異所的に誘導されることが分かった。この結果は、パッチトの機能がオルソデンティクルの発現を胚盤の縁を除く胚盤全体で抑制するために必要であることを意味した。正常発生においてCM細胞は胚盤の縁に着いてから運動を停止することを考えると、正常胚では胚盤の縁に「停止」シグナルが存在し、その停止シグナルがパッチトのeRNAi胚の胚盤では異所的に生じている可能性がある。また、パッチトの機能が抑制された領域にはCM細胞を停止させるだけでなく、CM細胞を誘引する活性があるかもしれない。今後これらの可能性を検証するために、ライブイメージングなどを組み合わせてさらに詳細な解析を行っていきたい。
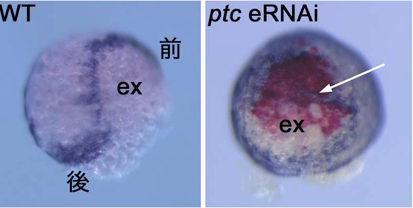 |
図3 正常胚(WT)とパッチトeRNAi胚( ptc eRNAi)の表現型の比較
パッチトdsRNAが導入された領域でCM細胞がとどまり、胚外組織(ex)が異所的に形成された(矢印)
おわりに
本年度は、オオヒメグモ胚でマイクロインジェクションを活用した細胞系譜の追跡や局所的な遺伝子機能の抑制、ライブイメージングが実現し、遺伝子発現のダイナミクスと細胞の運動や分裂、そして、それらを制御する仕組みについて記述することが可能になった。新しいモデル生物としてのオオヒメグモの価値は高まりつつある。動物の形態進化の仕組みを理解するまでには遠い道のりであるが、オオヒメグモのゲノムに真正面から向き合い、動物間の本質的な違い(動物グループ間で起こった過去の変化)を地道に探究したいと考えている。
