年度別活動報告
年度別活動報告書:2003年度
脊索動物と節足動物の共通祖先を理解する 4-2 クモ胚における胚葉形成と体軸形成の解析
小田広樹(研究員)
秋山-小田康子(派遣研究員)
山崎一憲(奨励研究員)
入江雅美(派遣実験補助員)
田中千咲(筑波大学生)
はじめに
一般的な多細胞動物の系統樹では、脊椎動物と節足動物の間に様々な動物分類群が位置づけられているが10)、分子遺伝学的な立場で脊椎動物とショウジョウバエの体の形づくりを比較するといくらかの共通点を見つけることができる(前後軸にそったパターンニング、背腹軸の形成、眼や心臓の形成など)11)。どうして脊椎動物とショウジョウバエは似ているのだろうか? 現在の主流の考え方では、分子系統解析の結果と組み合わせて、左右相称動物全体の共通祖先がこれらの発生形質をすでに持っていたと考えることで説明されている11)。もしこの仮説が正しいならば、多くの動物分類群 (例えば、棘皮動物など) でそれらの形質の欠失や極端な状態変化が起こったのであろうか? それとも現在の系統樹自体に大きな問題があり、実際には脊椎動物と節足動物は系統的に近い関係なのだろうか? これらの動物進化の根本問題に取り組むために、私たちはクモの発生に注目した。なぜなら、化石記録などを考えるとクモとショウジョウバエは5億年以上も前のカンブリア紀には系統が分岐しており、クモ胚とハエ胚の比較によって節足動物の祖先的な形質状態を知るための重要な手がかりが得られるだけでなく、カンブリア紀前後に誕生した脊椎動物や他の動物群との比較も可能になると期待されるからである。本研究は多くの左右相称動物で対等に比較しうる発生現象の解析に重点を置いており、本年度はクモの胚発生における中胚葉細胞の起源と体軸形成のメカニズムに関して重要な知見を得たので報告する。
結果と考察
(1)クモ胚の中胚葉細胞の起源
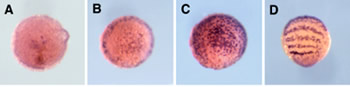
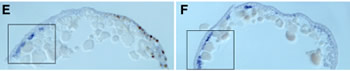
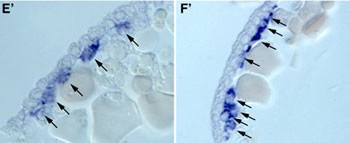
これまでクモ胚では中胚葉細胞がどこからどのように発生するのかはあまりよく分かっていなかった。私たちはまず、ファロイジン、DAPI、抗bカテニン抗体(シグマ)、抗At.Fkh抗体(私たちが新しく作製したもの)を用いてクモの初期胚における細胞の配列の変化と細胞タイプの分化を調べた。その結果、原口と呼ばれている部分(胚盤の中心)から、おそらく内胚葉細胞とクムルス間充織細胞(CM細胞)とが陥入していることと、胚盤の縁の部分から胚内部に入り込んでいる細胞が存在することが明らかになった。しかし、胚盤期(ステージ5)から胚帯期(ステージ7)へ転換するステージ(ステージ6)にはかなり多くの細胞が表面上皮層の下側に観察され、それらの細胞がどこから来たものかを同定することはできなかった。そこで私たちは、ショウジョウバエの中胚葉形成で重要な役割を果たすtwistのクモ相同遺伝子(At.twi) を単離し、その転写産物の発現をwhole-mount in situ hybridization法で調べた。その結果、At.twiが中胚葉細胞と思われる細胞で発現していることが示された(図5)。At.twiの転写はステージ5中期から胚盤の中心付近と胚盤の縁にある一部の上皮細胞で非同調的にはっきりとした規則性もなく始まり、そのAt.twiの発現を始めた細胞が個々に胚内部へ落ち込むことによって形成されているようであった。そしてこの観察の重要な点は、初期の中胚葉細胞の分布パターンに再現性のある非対称性は見られなかったこと、つまり、ショウジョウバエのように将来の腹側領域だけから中胚葉細胞が生まれることはなかったということである。クモ胚では、ショウジョウバエ胚と違って、背腹軸に沿ったパターン形成と中胚葉細胞の運命決定は独立なメカニズムで行われていることが考えられた。また、脊椎動物とは違って、クモの中胚葉が体軸形成に主導的な役割を果たしていないことも示唆された。さらに、twistと同じくショウジョウバエで中胚葉形成に必要とされるsnailのクモ相同遺伝子 (At.sna) の発現解析では、この遺伝子が中胚葉形成には関与していないことが示された。これらの私たちの結果は、節足動物が起源した後の進化においても中胚葉形成のメカニズムに大きな変化があったことを意味した。クモ胚で見られる初期中胚葉の放射相称性は、もしかすると節足動物の祖先状態を反映しているのかもしれない。
|
図5:オオヒメグモ胚におけるAt.twiの転写
産物の発現. (A)胚盤期の中期 (B)胚盤期の後期 (C)胚盤期から胚帯期の中間 (D)胚帯期 (E, Eユ)胚盤期の胚の切片 (F, Fユ)胚帯期の胚の切片。
(2)クモの体軸形成
昨年度までの結果は、CM細胞で産生されるDppシグナルがクモ胚の体軸形成において重要な役割を果たしている可能性を示唆した12)。そのCM細胞は胚盤期になってから胚盤上皮の裏側を一方向に移動するが、この非対称な運動に先行する非対称性が胚盤上に存在するかどうかはクモの発生における体軸の起源を考える上で極めて重要な問題である。昨年度の報告書にも記したが、ショウジョウバエや他の動物で知られている遺伝子forkhead、orthodenticle、labial、hedgehog、rhomboid、Wnt5のクモ相同遺伝子は胚盤で発現しているが、その発現パターンにはAt.twiやAt.snaと同じように、再現性のある非対称性は一切見られなかった。本年度は、ショウジョウバエと脊椎動物で背腹軸形成に重要な役割を果たしていることが分かっているshort gastrulation/chordinのクモ相同遺伝子 (At.sog) を単離し、その発現を調べた。その結果、At.sogの発現も初期の胚盤では対称なパターンを示したが、Dppシグナルに速やかに反応して発現が抑制され、非対称化した(図6A)。先に言及したforkheadなどの遺伝子も胚外領域の分化とともにその領域だけで発現が抑制されるが、それらの遺伝子と違ってAt.sogの発現は胚盤から胚帯への転換とともに徐々に腹側に限局された(図6B)。この時、At.sogの発現とほぼ同じ腹側領域でAt.fkhの発現が始まった。このようなAt.sogとAt.fkhの発現は脊椎動物の脊索形成を思い起こさせる。以上、私たちの観察結果はクモ胚の初期の放射相称性が (i) Dppシグナルによる胚外領域の分化誘導と (ii) At.sogの発現抑制に反映される胚領域内のパターニングの2つのステップによって左右相称性に転換することを示唆した。体軸形成におけるクモ胚とショウジョウバエ胚の違いは、ショウジョウバエ胚の直交した2つの軸(前後軸と背腹軸)が本質的には卵成熟の過程で形成されるのに対し、クモでは第2の軸(背腹軸)の形成が遅れ、胚盤期から胚帯期にかけて細胞間の相互作用を介して徐々にその軸が形成される点にあると考えられた。このようなクモの体軸形成は節足動物の祖先状態をいくらか反映している可能性がある。そしてもしかすると、クモの体軸形成では脊椎動物ともさほど違わないメカニズムが働いているのかもしれない。
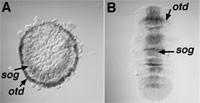
図6:オオヒメグモ胚におけるAt.sogとAt.otdの転写産物の発現.
(A)ステージ5の後期 (B)ステージ7
おわりに
私たちはオオヒメグモの胚発生を、主に遺伝子発現に基づいて解析を行ってきた。この解析によって、クモ胚のパターンがどのように形成されるか、そして、ショウジョウバエとどのように違うかを大雑把に把握することができた。それによって、クモの第2の軸(背腹軸)の形成を制御するメカニズムの解析が脊椎動物と比較をするためにも重要であることが分かってきた。そこで、なんとかして“クモ”で遺伝子機能を解析できる実験系を築きたいと考えている。しかし、現在までの私たちの感触ではオオヒメグモは実験操作を行うには必ずしも適していないようである。今後は、他のクモの開発も視野に入れながら研究を進めて行くつもりである。
参考文献
1) Philippe, H., Chenuil, A., and Adoutte, A. (1994) Can the Cambrian explosion be inferred through molecular phylogeny? Development Suppl.: 15-25.
2) Abouheif, E., Zardoya, R., and Meyer, A. (1998) Limitations of metazoan 18S rRNA sequence data: implications for reconstructing a phylogeny of the animal kingdom and inferring the reality of the Cambrian explosion. J. Mol. Evol. 47: 394-405.
3) Rokas, A., and Holland, P. W. H. (2000) Rare genomic changes as a tool for phylogenetics. Trends Ecol. Evol. 15: 454-459.
4) http://www.ncbi.nlm.nih.gov/blast/bl2seq/bl2.html
5) Wada, H., and Satoh, N. (1994) Details of the evolutionary history from invertebrates to vertebrates, as deduced from the sequences of 18S rDNA. Proc. Natl. Acad. Sci. USA 91: 1801-1804.
6) Turbeville, J. M., Schulz, J. R., and Raff, R. A. (1994) Deuterostome phylogeny and the sister group of the chordates: evidence from molecules and morphology. Mol. Biol. Evol. 11: 648-655.
7) Nardi, F., Spinsanti, G., Boore, J. L., Carapelli, A., Dallai, R., and Frati, F. (2003) Hexapod origins: monophyletic or paraphyletic? Science 299: 1887-1889.
8) Oda, H., Wada, H., Tagawa, K., Akiyama-Oda, Y., Satoh, N., Humphreys, T., Zhang, S., and Tsukita, S. (2002) A novel amphioxus cadherin that localizes to epithelial adherens junctions has an unusual domain organization with implications for chordate phylogeny. Evolution & Development 4, 426-434.
9) Oda, H., Akiyama-Oda, Y. and Zhang, S. (2004) Two classic-cadherin related molecules with no cadherin extracellular repeats in the cephalochordate amphioxus: distinct adhesive specificities and possible involvement in the development of multicell-layered structures. J. Cell Sci. (in press).
10) 白山義久(2000)、無脊椎動物の多様性と系統(監修:岩槻邦男、馬渡峻輔)、バイオディバーシティ・シリーズ5、裳華房
11) Carroll, S. B., Grenier, J. K., and Weatherbee, S. D. (2001) From DNA to diversity. Blackwell Science.
12) Akiyama-Oda, Y. and Oda, H. (2003) Early patterning of the spider embryo: A cluster of mesenchymal cells at the cumulus produces Dpp signals received by germ disc epithelial cells. Development 130: 1735-1747.