原点は10万馬力の鉄腕アトム
両親はともに小学校教師をしていました。戦後の教師不足の時代に18歳とかで代用教員となり、夜間大学で教員免許をとったと聞いています。私は幼い頃から本や漫画が大好きで、クリスマスや誕生日には両親が好きなだけ本を買ってくれるのが一番の楽しみでした。神話や童話など物語の世界に浸るのが楽しくて、小学生の時は、風邪をひくと家で1日中本が読めると内心喜んでいました。
とは言っても本だけではありません。知りたがり屋だったので、飛行機や鉱石ラジオづくりにも挑戦しました。小さな音がラジオから聴こえた時の喜びは今も忘れられません。プロペラにモーターをつけて、今でいうドローン型の飛行機をつくろうとしたこともありました。「絶対、飛ぶやろ!」と意気込んでスイッチを入れましたが、少しも浮き上がらずでがっかりしました。昔のモーターは力が弱かったのです。工作を通して工学に興味を抱くようになりました。中学生の頃にはすでに小さな集積回路ICが登場し、電子部品の小型化、高効率化が急速に進んでいることを新聞で知り、人工知能を搭載したロボット登場も夢ではないぞとワクワクしました。やっぱり私たちの世代の原点は、鉄腕アトムです。
生後100日記念。祖父が易者さんに名前を考えてもらった際、「この子は研究者になる」と言われたそうだ。
3歳の誕生日に両親と。両親はともに昭和4年生まれ。父は中学の時に予科練に入り特攻隊に志願していたが、兄(私の叔父)が戦死していたため上官に出陣を止められたそうだ。
妹と家の近所で。10歳離れているので、私は一人っ子の時期が長かった。
新種の菌を探し歩いた高校時代
高校時代を過ごした尼崎北高校には熱心な先生方がいて、数学ではコンピュータの基本である記号論理学、地学では球面幾何学など、教科書だけにたよらない独自の授業をしてくれました。その一人、真菌を培養し新種を探すことが趣味の横山了爾先生が、生物の授業でカビやキノコの学名と絵を描きその特徴を語ってくれたのです。ラテン語の学名なんて何のことやらわかりませんし、「けったいな先生やなあ」と思っていましたが、どこか惹かれるところがあり先生が顧問を務める生物部に入りました。それからは、田んぼのあぜ道で土や犬のフンを拾ってきてはその中の菌を培養し、新種を探す日々です。顕微鏡にカメラなどついていませんでしたから、観察結果はすべてスケッチし、一生懸命に専門書や図鑑と見比べました。培地づくりは、カビの胞子を完全に殺すために120℃の滅菌を3日にわたって3回もくり返す大変な作業です。そんなことをしている高校生は珍しいですよね。キノコを探しに高野山の宿坊へ合宿にも行きました。
時々、卒業生が遊びにきて、その中に阪大の生物学科に通っている4年上の先輩、井上明男さん(元・大阪大学准教授)がいました。私も同じ進路を目指そうかと考え始めていた時、横山先生が阪大の基礎工学部にその頃新設された生物工学科が面白そうだと教えてくれたのです。生きもののしくみに興味がありましたが、実は得意科目は物理で、テストでは満点もとりました。理論を使い問題を深く掘り下げて解くことが好きで、暗記は嫌いだったのです。生物工学科には脳科学、数理生物学、物理学、工学など異分野の専門家が集まっており、英語名は「Biophysical Engineering」、自分にぴったりだと思いました。
高校3年生の秋、全国的に加熱していた学生運動の波が私たちの学校にも波及してきました。「制服反対」、「生徒心得廃止」を訴え、みんなで期末試験をボイコットしたのです。先生たちは生徒集会を開いてみんなの意見を聞き、生徒心得も制服も全部なくしてくれました。騒動が収まって、いよいよ受験という時に「試験をボイコットしてるから、内申書を書かれへん。どうすんねん」と怒られましたけどね。結局、レポートで許してくれました。本当に優しい先生方でした。
尼崎北高校時代は光学顕微鏡を覗いて菌糸や胞子の観察をするのが日課だった。
尼北生物部の仲間と。学生実験室では化学部と物理部も活動をしていたので彼らの実験からも刺激を受けた。(本人:後)
高校の夏休みに父(右)の職場の研修会に同伴し鳥取砂丘を訪れ新種のカビを採集した。
生物部顧問の横山先生(最前列左から3人目)が尼崎北高校を離れる時に生物部OBが集まり送別会をひらいた。(本人:2列目右から2人目)
生きものを「物理の眼」で観る
私が入学した当時、阪大はまだ大学紛争中で、構内は立て看板だらけで授業はほとんどありませんでした。そこで、気の合う仲間たちと量子力学や制御工学の英語の教科書を読んで議論する勉強会を自主的に開きました。生物工学科には大きな談話室があり、先輩や先生とお茶を飲みながらよく気軽に話しました。30代、40代の若い方が多く、「先生」と呼ぶと怒られることもある程、生徒と先生の垣根が低かったのです。学科の授業が始まる3年の時には紛争の影響はなくなりました。特に印象に残っているのは中村伝先生(故人)の「統計熱力学」と大沢文夫先生(現・大阪大学名誉教授)の「分子生物学入門」です。中村先生の授業は、毎回プロローグとエピローグが用意されていて、「わかるとはこういうことなのか」と実感がもてる素晴らしい時間でした。大沢先生からは生きものを「物理の眼」で観るという考え方を学びました。
4年生から、三井利夫先生(現・大阪大学名誉教授)の研究室で車軸藻類のニテラを用いた生体膜の研究を始めました。ニテラの節間細胞は直径1ミリほどの大きなもので、その中を原形質が高速でぐるぐると回る原形質流動が観察できます。この細胞から原形質を取り出すと最初はベチャーっと広がるのですが、次第に表面にリン脂質の膜ができ、自然におまんじゅうのような形をつくるのです。これを原形質ドロップと呼びます。私は原形質ドロップに電気刺激を加え、形の変化を見る実験を始めました。電気刺激によって膜の興奮と表面張力などの変化が同期するというのが三井先生の予測でした。元々、物性物理学がご専門で、物質の性質がガラリと変わる相転移も見ていたので、生体膜の興奮についても物理の視点から面白い現象をとらえたいと考えておられたのです。今振り返ると卒研生にはかなり難しいテーマですが、光センサーを使った装置を自作して観察をくり返しました。わずか2回ですが原形質ドロップが心臓みたいにポコポコと自励発振をする現象が起き「不思議なことが起きるもんや」と驚きました。でも中で何が起きているのかはわかりません。原形質内に張り巡らされた細胞骨格アクチンのネットワークを壊さずに取り出せたために、起きた現象だと推測していますが、真相は今も謎のままです。いつか解いてみたい宿題の一つです。

学部時代の学科主任は脳の記憶・学習のしくみを探っていた塚原仲晃先生(最前列右から6人目)。名大の教授となった小田洋一さん(最前列左から5人目)や第一三共の社長となった中山譲治さん(2列目左から5人目)は一緒に勉強会をひらいた仲間だ。(本人:2列目右から5人目)
三井研や大沢研の仲間とニテラを採集するために六甲山植物園に出かけた。池の中をくまなく探したがみつからなかった。(本人:前列左から2人目)

彦根、米原周辺にニテラがいるという噂を聞きつけて、朝から10ほどの池を探しまわり、日が暮れる頃にようやく見つけた。
筋収縮のしくみに挑む
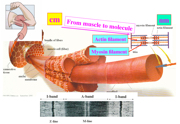
当時はほとんどの同級生が就職するなか、大学院へ進みました。研究者になると決めいていたので迷いは一切なく、両親からも「就職しないの?」の一言もありませんでした。好きな道を進んだらいいと、自由にさせてくれたのはありがたかったです。しばらくは、ニテラの研究を続けていましたが、体内で起きている現象に目を向けたいと思い始めました。三井研の主軸はX線による生体分子の構造解析でしたので、その強みを生かして構造から生きもののしくみを知る研究をしようと考えました。まずはテーマ探しです。八百屋さんでほうれん草を買い、すりつぶして葉緑体を集めたり、お肉屋さんで鶏肉を買い腱からコラーゲン集めるなど、いくつかの材料にX線をあててみるなかで、筋肉に関心をもちました。筋肉はアクチンの細い繊維とミオシンの太い繊維が、交互に並んでできており、アクチンとミオシンが結合と解離をくり返し、繊維が滑り込むことで収縮します(図1)。分子のミクロな構造変化が積み重なって大きな運動が起きることが面白いと思い、そのしくみに挑みました。筋肉の研究には長い歴史がありましたが、アクチンとミオシンが相互作用することで、それらの分子構造がどのように変わり力が発生するのか、具体的なことは全くわかっていなかったのです。
隣の大沢研で、光学顕微鏡で筋肉の研究をしていた柳田敏雄さん(現・大阪大学名誉教授)に、アクチンの繊維が長くて多いカニの筋肉を取り出す方法を教えてもらいました。アクチン繊維にミオシンが結合して硬直した状態と解離して弛緩した状態の筋肉のサンプルをつくりました。結晶化したタンパク質のX線による構造解析が可能になり始めた頃です。レントゲン写真はX線を投影した影を記録しますが、目に見えない分子の構造を解析する時は、X線の細いビームを当て回折反射光の強度とパターンを記録します。結晶の場合だと、スポットがたくさん現れそこから周期的な構造が見えてくるのです。ところが、筋肉は繊維状で結晶化できません。当時のX線装置は強度が弱かったこともあり、筋肉にX線を1週間当て続けてもうっすらとしたパターンしか見えませんでした。繊維が長持ちするグリセリン筋をつくったり、アクチンだけを精製して繊維に重合させたものを使うなどの工夫を重ねましたが、細かな構造が全然見えてこない。結晶化できないタンパク質のX線パターンから詳細な構造を解析する方法は、まだ誰も見出していなかったのです。
大学院の3年生のころは毎日X線パターンとにらめっこして、「どんなふうに解析したらええんやろ?」と考え続けていました。指導してくださっていた助手の若林克三さん(現・大阪大学名誉教授)がカナダに留学され、一人で模索していたのです。1年ほど考え続けるうちにアクチンとミオシンの情報が混じっている筋肉のX線パターンの中から、アクチンの情報だけを抽出する解析法がひらめきました! 今だったら、思いついたプログラムをパソコンで作成して動かせばよいのですが、当時は研究室にパソコンなどありません。大学の大型計算センターにコードを打ち込んだパンチカードの束を送らなければならず、しかも1日に1回しか便がありませんでした。結果の出力が翌日届くとプログラムのエラーにより途中で計算が止まっている。修正して送ると翌日は次の行でまたエラー。そんなことのくり返しでした。結果を描画するプログラムも自作し、数ヶ月後になんとか結果を描きだすことができました。先生たちはすぐには結果を認めてくれませんでした。一生懸命に計算式を書いて自分の解釈が間違っていないことを説明してようやく納得してもらったのです。
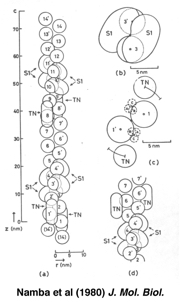
解析の結果、筋肉の硬直と弛緩にともなうアクチンとミオシンの結合パターンの変化を定量的に示すことができました(図2)。それまで、ミオシンはアクチン繊維上のアクチン分子に対して特定の分子を選ばず結合するとされていました。しかし、私が見出したのは周期的な結合パターンで、当時の常識から外れている結果だったのです。最初に投稿した論文は取りつく島もなくリジェクトされました。解析方法について詳しく書きなおして再度投稿し、これが学位論文になりました。約5年間をかけて自力で到達した成果でしたが、当時の分解能は30 Å程度、アクチンが丸に、ミオシンが楕円ぐらいにしか見えなかったのです。これではいかんと思い、高い分解能での解析技術を学ぶため、タバコモザイクウイルス(TMV)という棒状の植物ウイルスのX線による構造解析に取り組んでいた米国・ブランダイス大学のドナルド・キャスパー(Donald Caspar)教授のもとに留学しました。当時、TMVでは7 Åの分解能で構造が見えていて、より高分解能の解析をめざしていました。

図1:骨格筋のサルコメアという収縮ユニットを形づくるアクチン繊維とミオシン繊維
泳いで長距離を移動するワタリガニ(ガザミ)を魚屋さんから仕入れて筋肉の研究に用いた。
大学院時代は学年も研究室も関係なく、テニスやスキーで学科の仲間とよく遊んだ。柳田敏雄さん(後列左から4人目)は遊びの師匠であり、カニの解剖の師匠でもあった。(本人:後列右から3人目)
図2:大学院時代のX線による構造解析で見えた、アクチン繊維の構造とミオシン頭部の結合パターン。Namba et al (1980) J. Mol. Biol. より引用。
生きものを構成する分子の構造を原子レベルで解明するにはÅ(オングストローム)スケールの分解能が必要だ。
ウイルスの構造が教えてくれたこと
タバコの葉にモザイク状の斑紋を引き起こすTMVは、1883年に発見されたウイルスです。1956年にロザリンド・フランクリンロザリンド・フランクリン【Rosalind Franklin】1953年にDNAの配向繊維試料のX線解析を行い、二重らせん構造の解明につながる回折パターンを撮影した。その後、TMV研究へと移ったが、1958年に37歳の若さで亡くなっている。とキャスパー先生がX線解析によるらせん構造の分子モデルを同時に発表し、その後も弟子たちによって詳細な構造を見る挑戦が脈々と続けられていました。私が参加した時には、すでに30年の研究の蓄積がありましたが、TMVは棒状で結晶化できないために解析が難しく、原子レベルでの立体構造の解明には到達できていませんでした。
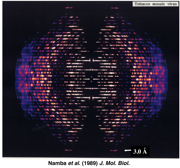
キャスパー先生の下でのポスドク生活では、X線の装置を1台ほぼ自分専用として使えました。学生の時は1台の装置を10人ほどで共有していたので、私にはまさに天国のような環境です。ここで高精度のX線パターンを撮る試みを始めました。TMVは結晶化はできませんが、濃縮すると並んで配向した液晶をつくります。研究室の棚の奥には20年もののTMVの配向液晶試料が鎮座していました。長い歳月をかけて熟成されたことで、液晶層同士が融合し大きく成長していたので、ありがたいことに私はこれを使ってチャンピオン・データを撮ることができました(図3)。ただ、この試料は重原子などが何もついていないTMVだったので、原子レベルの構造を知るにはさらなる情報が必要でした。
X線による構造解析では、金や白金など重い原子を分子に取り込ませ、それを目印に原子の立体的な配置を知る重原子置換法がよく使われます。結晶化できる分子の場合は、これを用いて2次元の複素変数方程式を解くと立体構造が見えるのです。TMVも重原子置換体のX線パターンが蓄積されていたのですが、結晶ではないため10次元の複素変数方程式を解かなければならず、理論上は不可能でした。しかし、研究室の先輩であるリー・マコウスキー(Lee Makowski)博士とジェラルド・スタッブス(Gerald Stubbs)博士が、細い層線反射が集まってできた波状のX線パターンから情報を引き出すというアイディアを出しており、私はこれを使って精度の高い解を得る解析プログラムの工夫を始めました。
アメリカ生活が2年半ほど過ぎた頃、ジェラルドがテネシー州にあるヴァンダビルト大学に職を得たので、私も数ヶ月遅れてついて行くことにしました。ブランダイス大学があるボストンから1700キロを、車に荷物を載せて引越しです。南部訛りの英語は最初全く聞き取れず、慣れるのに大変苦労しましたね。引っ越した後も年に2、3回は車でボストンに戻り、キャスパー先生と議論しながら研究を続けました。重原子置換体の解析の工夫は難しい課題でしたが、良いタイミングで人の出会いに恵まれました。ゴードン会議ゴードン会議【Gordon Research Conference 】1931年から開催されている国際学術会議。オーガナイザーによる招待、参加の承認を原則としている。でたまたま同じ部屋に宿泊した研究者が見つけたばかりの解析法を紹介してくれ、それが私たちの問題にも応用できたのです。解析法の工夫がうまくいったので、次は三次元の原子モデルづくりです。当時、この作業のためにはグラフィック専用のコンピュータと特殊なディスプレーターミナルが必要で、これを借りにドイツのハイデルベルグにある欧州分子生物学研究所(EMBL)へ3週間出張し、基礎モデルをつくりました。その後、ニューヨークのコロンビア大学にもこの装置が導入されたので、マンハッタンへ出かけて作業を続けました。自分の研究室に装置がないので、作業の途中に構造を見ながらジェラルドやキャスパー先生と議論できません。何とかしたいと思って、ブランダイス大学にあった二次元のカラー静止画描画装置を活用し、陰影をつけるなどの表現ができるプログラムをつくり、美しく見やすい立体的な図が描けるようにしました。キャスパー先生がその図にえらく感動して「これでまず『Science』に出そう!」とすぐに、論文を書いてくれ、それが1985年に掲載されました。「『Science』って気楽に論文送ってもいい雑誌なんや」と知ったのがいい経験でした。
こうしてTMVタンパク質を形づくる約2400個の原子の立体配置を2.9 Åの分解能で解明することに成功しました(図4)。原子モデルが完成したことで、詳細な全体構造からタンパク質とRNAがどのように積み重なってウイルスをつくっているのか、そのしくみが見えてきました。分子間にマイナスの電荷が向き合っている部位があり、そこに結合する水素イオンが構造の橋渡しとなっているのです。pH(水素イオン濃度)が一定以上になるとTMVタンパク質が自ずと集合してウイルス形成の核となる構造ができ、そこにRNAが収まると一気に組み立てが進みます。RNAを物差しにすることで、必ず一定の長さで組み立てが止まるという見事なしくみです。実は、キャスパー先生は水素イオンと結合する部位の存在を20年前に予測していました。私が実際の原子モデルからそれを見出したのはちょうど12月、クリスマスパーティでキャスパー先生に報告ができ、とても喜んでもらえました。これらの成果を1986年『Science』に発表しました。TMVの研究を通して私は研究者としての道を切り拓くことができたのです。

米国・ブランダイス大学でドナルド・キャスパー先生と。
ブランダイス大学のあるマサチューセッツ州に隣接するニューハンプシャー州など近郊の山々にはスキー場がたくさんあり、研究センターの仲間とよく出かけた。
ジェラルド・スタッブス博士(左端)のご家族とのクリスマスパーティ。(本人:右端)
ポスドク時代の愛車ホンダアコードと。ヴァンダビルト大学があるテネシーから、ニューヨーク、ボストンへ出張する時はいつも1700キロの道のりを2日かけて一人で運転した。
キャスパー先生ご夫妻。(本人:撮影)キャスパー先生の研究室に出張に行くと必ず先生がサンドウィッチを作ってくださり、外で一緒に食べながら議論した。
図3:TMV配向液晶試料のX線繊維回折像。Namba et al. (1989) J. Mol. Biol. より引用
図4: TMVの原子モデル。Namba & Stubbs (1986) Scienceに発表した成果
1996年秋、松下国際研で開催した谷口シンポジウムの際に、TMV研究でお世話になった方々を自宅に招いた。右からキャスパー先生、ケン・ホームズ博士、ジェラルド・スタッブス博士ご家族。(本人:撮影)
細菌の精巧な運動器官・べん毛
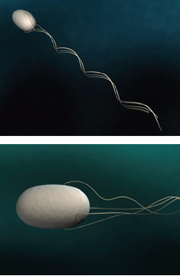
1986年に大沢先生と宝谷紘一さん(現・名古屋大学名誉教授)にお声がけいただいて帰国し、「ERATO宝谷超分子柔構造プロジェクト」のグループリーダーとして、細菌べん毛の研究を始めました。大腸菌やサルモネラ菌は体表に生えたべん毛を回転させて高速で泳ぎます(図5、6)。プロペラの役割をするべん毛繊維は、11本の細長い繊維(素繊維)からなるチューブ構造で、1種類のタンパク質フラジェリンで構成されています。べん毛繊維全体は、ゆるやかにねじれた左巻きのらせん状となっており、細菌が方向転換する時にはらせんの向きが瞬時に右巻きへと切替わります。私はべん毛繊維がもつこのスイッチ機構を構造から解きたいと考えました。
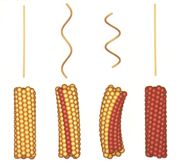
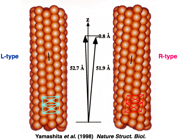
このプロジェクトには企業からもメンバーが集まっており、異なるバックグラウンドをもつ仲間たちから大きな刺激を受けました。大沢先生も毎週末、名古屋から筑波の研究室に通ってくださり、みんなで議論を重ね研究ができたのです。べん毛繊維の構造については大沢先生のお弟子さんの朝倉昌さん(故人)が1970年に「2状態素繊維モデル(図7)」を発表していました。素繊維は周期構造の異なる2つの形(L型、R型)をとることができ、それが混在することによってらせん状にねじれた構造をとるというものです。実際に素繊維の傾きが異なる2種類の直線型べん毛繊維が見つかっており、私たちはこれらの配向液晶をつくってX線による解析を行いました(図8)。そして、原子1個分以下のわずかな立体構造の違いによってべん毛繊維のねじれや曲率が生まれているという、構造からのモデルシュミレーションと光学顕微鏡による計測値が一致する結果を得ました。べん毛繊維が力をうけるとL型とR型の割合が変化することでらせんの向きが切替わり、束になっていた繊維がほどけて方向転換ができるのです。
この研究グループに松下電器の山下さんが参加していたご縁で、松下が京阪奈(けいはんな)学研都市に建てる新しい研究所で生物物理の研究をしないかと声をかけていただきました。5年間の期限付きですが、お金は十分に使って好きなことをやってくださいという夢のようなお誘いでした。当時まだ新しい技術として高性能のクライオ電子顕微鏡の開発に成功していた藤吉好則さん(現・名古屋大学客員教授)と共同研究を始めていたのでお誘いすると、すぐに「いくいく!」と快諾してくれました。松下中央研究所所長の新田さんに、電子顕微鏡など自分たちが必要なセットアップとそれなりに高額な予算見積を一覧にして相談すると、二つ返事ですべて用意してくださることになりました。研究所の建設計画途中にバブルがはじけ完成は予定より遅れましたが、1994年から京阪奈にできた国際研究所で活動を始めました。
ERATO宝谷プロジェクトのグループメンバー。顧問だった大沢文夫先生(1列目左端)は毎週、名古屋から筑波に通い議論してくださった。(本人:右端)
図5:数本のべん毛を束にして回転させて泳ぐ細菌(CG)
図6:細菌のべん毛模式図。根元には高速回転するモーターがある。
図7:べん毛繊維のらせん状の構造について説明した「2状態素繊維モデル」参考文献:S. Asakura : Adv. Biophys., 1 (1970) 99-155
図8:周期長のわずかに異なる2つの型のべん毛素繊維からなる、L型(左)とR型(右)の直線型べん毛繊維構造。Yamashita et al. (1998) Nature Struct. Biol. より引用
ERATO宝谷プロジェクトの後半には、メンバーの子どもたちも大きく育ち集まりがにぎやかになった。
1999年インド・ニューデリーで開催された国際生物物理会議に柳田敏雄さん(左)、宝谷紘一さん(右)と参加した。(本人:撮影)
誰もやっていないことへの挑戦
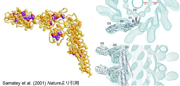
従来の電子顕微鏡による生体試料観察は、乾いた試料に真空中で電子線を浴びせるので焼いた干物を見ているようなものでした。藤吉さんが日本電子と開発したクライオ顕微鏡では、タンパク質を凍らせ、「生の姿」を直接見ることが可能です。私たちはこれとX線とを組み合わせて、べん毛繊維の構造のさらなる解析を進めました。フラジェリンは繊維を形成するのでそのままでは結晶化できません。研究員の今田勝巳さん(現・大阪大学教授)とサマティ・ファデルさん(Samatey Fadel、現・沖縄科学技術大学院大学)が、繊維形成に必要な一部の領域だけを切り取ることで、フラジェリンの結晶の作成に成功しました。でも厚さは5μmほど。研究室のX線装置では解析できない薄い試料でしたが、ちょうどこの頃、大型放射光施設SPring-8が稼働を始め、その高輝度X線を活用することで回折データを収集し2 Å分解能で構造が解けました。この分子モデルを電子顕微鏡から得た繊維全体の大まかな構造の3次元密度マップに当てはめることで、擬似的な原子モデルが完成しました(図9)。コンピュータで繊維に力を加え引っ張るシミュレーションをすると、最初は徐々に伸びていくだけですが、一定の力を越えたところで急激に形が変化する様子が見えました。分子中に疎水性のアミノ酸が密に集まった部分があり、そこが大きな形の変化を生む原動力になっているようでした。タンパク質の立体構造の柔軟性が、精巧なスイッチ機能を実現しているのです。
フラジェリンの断片からのモデルではなく、全長のフラジェリンからなるべん毛繊維全体構造の詳細な解析ができないだろうか。クライオ電子顕微鏡法は試料を傷つけないよう低い電子線量で撮像するので、小さい分子の像は特にノイズレベルが高くてボンヤリとしか見えないのですが、何とかこれを改良する方法を考えないといけませんでした。当時は暗中模索状態で、原子レベルの分解能を達成できると考えている人はほとんどいませんでしたが、解析技術を突き詰めれば詳細な像が見えてくるはずだという確信がありました。写真フィルムで撮像していた時代ですので、現像の仕上がりは翌日、いい写真は100枚に1枚程度です。本当に地道な作業でしたが、研究員の米倉功治さん(現・理研 放射光科学総合研究センター主任研究員)、眞木-米倉さおりさん(現・理研 放射光科学総合研究センター研究員)が根気よく続けてくれました。一万本以上のべん毛繊維像を収集し、そこから約100本の高画質像だけを選び解析して立体構造を再構成することに成功。2003年にR型べん毛繊維の原子モデルを発表しました(図10)。データ収集と解析に6年をかけた成果です。その後、L型の構造解析にも成功しました。2つの立体構造を比較すると、べん毛繊維の内側はほとんど構造がかわらず、外側は柔軟に変化することなど、全体として安定な構造を保ちながらも、しなやかに変化する賢い繊維の実態が見えました。直径わずか20 nmの細菌のべん毛がようできているなあと思います。最適な環境への移動は細菌にとって死活問題です。進化の中で洗練されてつくられたデザインなのでしょう。

図10:べん毛繊維の電顕写真(左)と解析して得られた原子モデル(右)。多くの写真を重ね合わせることで、埋もれていた情報を引き出すことができる。Yonekura & Maki-Yonekura et al. (2003) Natureより引用
松下電器産業(株)国際研究所のメンバーと。日本電子(株)と新たに開発したクライオ電子顕微鏡で、私のグループはべん毛繊維の構造を、藤吉好則さん(2列目右から2人目)のグループは膜タンパク質のバクテリオロドプシンやアクアポリンの構造を高分解能で解析できた。(本人:2列目右端)
1997年からERATOプロジェクトを新たに立ち上げ、大沢文夫先生(1列目右から6人目)、宝谷紘一さん(1列目右から4人目)、藤吉好則さん(1列目左から3人目)にもアドバイザーに加わっていただいた。(本人:1列目左端)
図9:X線結晶構造解析よって得られたフラジェリン原子モデル(左)。クライオ電子顕微鏡の画像解析結果に原子モデルがぴったりとおさまった(右)。Samatey et al. (2001) Natureより引用
30種類の部品が組み上がってできるべん毛
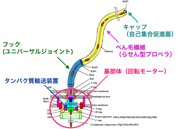
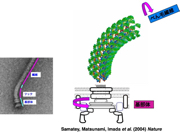
X線結晶解析法とクライオ電子顕微鏡法を組み合わせて、回転モーターや輸送装置など、部分ごとにべん毛の構造を見る研究を続け、約30種類のタンパク質が組み立てられ、調節し合ってはたらくしくみを明らかにしていきました。回転モーターの力をべん毛繊維に伝える自在継手(ユニバーサルジョイント)の役割をするフックは、曲がった状態で安定にはたらきます。フックの構造を解くと、11本の各素繊維が伸び縮みして構造がダイナミックに変化することがわかりました(図11)。実際、1秒間に何百回も伸び縮みするのです。
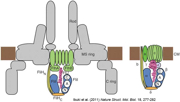
フラジェリンをべん毛繊維の先端に送り出す輸送装置の構造からは予想外のことが見えました。べん毛の根元にある輸送装置は、フラジェリンの構造を解きほぐしながら、直径2 nmの細長いチャネルへと毎秒20分子も送りこみます。私たちが立体構造を解いたところ、なんとミトコンドリアの内膜にあるF 型ATP合成酵素の膜外ドメインとそっくりだったのです(図12)。F型ATP合成酵素は、あらゆる生物がエネルギー源とするATPを合成する重要な分子で、回転モーターでもあります。細菌のべん毛とはまったく関わりがないと思われていましたが、構造を原子レベルで見ることで意外なつながりが明らかになったのです。
少し時間が遡りますが、2002年に阪大に発足したばかりの生命機能研究科へと移った私たちのグループは、2004年に文科省の予算で新しい電子顕微鏡を導入できました。フィルムでなくCCDカメラを導入し、すぐに像の良し悪しを判断できるようにしました。さらに、研究員の加藤貴之さん(現・大阪大学助教)と、当時学生だった藤井高志さん(現・大阪大学特任助教)が様々なテストをくり返し、クライオ電子顕微鏡法での解析技術の改良を進めてくれました。試料を閉じ込める氷の厚みをできるかぎり薄くしたり、温度を微妙に調整するなど、細かな工夫を重ねることで、できるだけノイズを除去し、コントラストを大幅に向上させたのです。何年もの歳月を費やしていたデータ収集と解析の時間が短縮され、短期間で高分解能の立体像が見えるようになりました。いよいよ学生時代の宿題に戻る時が来たと感じました。
図11:べん毛繊維に回転トルクを伝えるフック。Samatey, Matsunami, Imada et al. (2004) Natureより引用
図12:べん毛のタンパク質輸送装置(左)とATP合成酵素(右)。Ibuki et al. (2011) Nature Struct. Mol. Biol. より引用
2006年、米国・ユタ大学でべん毛を研究しているケリー・ヒューズ博士(左から3 人目)夫妻が、阪大の研究室に3ヶ月滞在してくれた時。(本人:左から5人目)
再び筋肉に挑戦
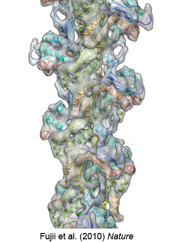
学生の時、何とかして見たいと思いつつ見えなかった筋肉の構造の解析に、30年ぶりに挑戦することにしました。生命機能研究科の一つ上の階にある柳田敏雄さんの研究室へ藤井さんと一緒に行き、ウサギの骨格筋のアクチン試料をほんの少しもらいうけました。アクチン繊維の直径はべん毛繊維の半分以下、幅7 nmの極細のリボン構造です。さすがに苦戦を覚悟していましたが、藤井さんはわずか2週間ほどで原子レベルの構造解析に成功しました。早速それを柳田さんに見せると「世界の研究者真っ青やな!」と言ってもらえました。実はこの30年の間にも、数多くの研究者がアクチンの構造解析に挑戦していたのですが、分解能は10 Å程度が限界で、ぼんやりした像しか見えていなかったのです。私たちの解析結果は6.6 Å分解能で、アミノ酸が連なってできる2次構造をすべて鮮明に見ることができたのです。一分子だけで存在する時と繊維を形成する時の構造の違いもはっきりと見えました。2010年にこの成果を『Nature』に発表しました(図13)。
続いてアクチンとミオシンの複合体の構造を解析すると、アクチン繊維の軸に非常に近いところにミオシンの頭部が結合していることがわかりました。これは私が学位論文で記述した結果を証明するものでした。あの時の分解能は30 Å、ミオシンは楕円にしか見えていませんでしたが、必死で解析した結果が間違ってなかったことが、30年越しで証明できて嬉しかったです(図14)。
さらに、この原子モデルを用いて筋収縮のしくみを論理的に説明するモデルの構築を始めました。ミオシン繊維とアクチン繊維の滑り運動の力の発生源は、ATPの加水分解で生じるエネルギーを使って起こるミオシン頭部の構造変化だとされてきました。この場合、ATPの加水分解一回あたり約10 nmのすべりが起きることになります。それに対し、1985年に柳田さんがATPの加水分解一回あたり60nmもすべっていることを示し、ミオシンの構造変化だけでは筋収縮のしくみが説明できないことを明らかにしていました。しかし、なぜ筋肉はこれほど省エネルギーかつ高速で収縮できるのかという謎は残されたままだったのです。これに原子モデルが答えを出しました。ミオシン頭部の大きな構造変化はアクチンへの結合時に起きるのです。ミオシンの頭部にはATPを結合するポケットがあり、加水分解はすぐに起こりますがポケットは閉じたままなので、加水分解産物であるADPとPiは解離できず、ミオシン単独では加水分解のサイクルはそれ以上進みません。しかし、ミオシン頭部がアクチン繊維に結合するとそのポケットは大きく開き、ADPとPiはすぐに解離し、代わりにATPが結合します。その結果、ミオシン頭部にアクチン繊維への結合時とは逆の構造変化が起こり、頭部の先端部分がアクチン分子とぶつかるためにアクチン繊維から解離します。このようにミオシン頭部の大きな構造変化によってアクチン繊維との結合・解離がすばやく起きるのだとわかりました。また、ミオシン頭部がアクチン繊維から解離する際には、ごくわずかな時間だけ生じる弱い結合状態があり、その結合構造が繊維軸に対して非対称なため、熱ゆらぎによる分子のランダムな運動(ブラウン運動)によりミオシン頭部が解離する際、その方向をうまく一方向に偏らせていることもわかりました(図15)。生体分子は体温由来の熱でつねにフラフラとゆらいでいます。筋収縮の過程で、ATP加水分解のエネルギーの大半はアクチンとミオシンの結合・解離の制御に使われ、両繊維が相互にすべり込む時のエネルギーはブラウン運動を一方向に偏らせてうまく活用していると考えられます。これで、ATPの加水分解一回あたり60 nmもの長距離すべりこみ現象も論理的に説明できます。筋肉の研究を長年はなれていたので、300本ほどの関連論文を読み漁り、似たようなモデルの記載がないかを確認してから論文を書き上げ投稿しました。しかし、そこからがまた苦難の道のりでした。なかなか論文が通らず、発表できたのは1年半後でした。思い切った新説を主張すると、気に入らない人が必ずいるものなのです。

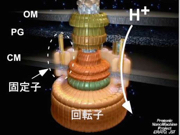
細菌べん毛の回転モーターについても、省エネルギーで動くしくみが見えつつあります。2001年頃から南野徹さん(現・大阪大学准教授)を中心に、一分子光学ナノ計測法によるモーターの回転計測を進めていました。モーターには固定子と回転子があり、水素イオンの流れをエネルギー源に動いていることが明らかになっていました(図16)。回転の様子を高精度で捉え、水素イオン濃度を低下させる実験を行って、水素イオン流のエネルギーの大半は固定子と回転子の結合・解離の制御に使われていることが見えてきました。回転そのもののエネルギーにはここでもブラウン運動がうまく利用されているようなのです。固定子と回転子の構造を原子レベルで解明することによってこれを証明することが次の宿題です。人間がつくる機械に比べて生きものは極めて省エネルギーで動きます。べん毛の回転モーターはF1レーシングカーのエンジン並の高速で回転しますが、消費エネルギーは1京分の1ワット、エネルギー変換効率はほぼ100%です。熱ゆらぎをうまく活用しながら効率的に動くしくみは、筋肉やべん毛モーターに特殊なものではなく、さまざまな生体分子の構造に組み込まれていると私は考えています。
2009年の研究室のお花見(万博記念公園)。加藤貴之さん(3列目左端)、藤井高志さん(3列目左から4人目)、今田勝巳さん(1列目左から2人目)、南野徹さん(1列目右から3人目)。(本人:2列目右端)
図13:アクチン繊維の原子モデル。Fujii et al. (2010) Natureより引用
図14:ミオシン頭部の結合したアクチン繊維の電顕写真(左)と解析して得られた原子モデル(右)。Fujii & Namba (2017) Nature Commun. より引用
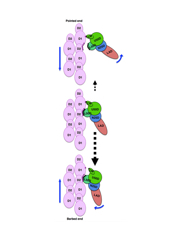
動画:アクチン(薄紫色)とミオシン頭部(多色)の立体構造。原子レベルで構造を解析することで、ミオシン頭部のダイナミックな構造変化が詳細に見えてきた。
図15:熱ゆらぎによるミオシン頭部の解離の方向を決める弱結合状態の非対称な結合様式。上方向には結合がはずれやすく、下方向にははずれにくいため、熱ゆらぎのフラフラとしたランダムな運動をうまく一方向に偏らせて動く。(薄紫色がアクチン、多色がミオシン頭部)
図16:細菌べん毛モーターのモデル図。
2015年の研究室のお花見(万博記念公園)(本人:2列目左端)
生きものは積み木細工ではない
数年前に、大学時代の大沢先生の講義のノートが実家から出てきました。そのノートには、私がこれまで研究してきたテーマである筋肉、TMV、べん毛のことがすべで書いてありました。「物理の眼」から見て面白い生きもののテーマを、この時にすでに刷り込まれていたようですね。自分では意識していなかったので、ノートを見て驚きました。そして、ゆらぎという切り口もこのノートに出てきます。

1970年代に湯川秀樹先生が監修された物理学の書籍の生物物理の項を大沢先生が担当した際、原稿を読んだ湯川先生から「生物っていうのは積み木細工ですね」と言われたそうです。原子が集まってタンパク質や核酸などの高分子が構成され、それが組み合わさって生まれる高次の機能で生きものは存在しています。構成する部品の一つ一つは物理の法則に従って動きます。しかし、嵐のような熱ゆらぎに常にさらされている生体分子が機械仕掛けのように動くわけがない、物理学者が見ていない生きものならではのしくみが絶対あるはずだ。大沢先生はそう考えておられたのです。「湯川先生にいつか積み木細工ではないということを見せたかった」とおっしゃっており、生きものらしさを探るキーワードの一つをゆらぎと考えていらしたのです。昨年の暮れ、大沢先生に私たちの最近の成果をお見せした時、「革命的やね」とポツリとおっしゃってくださいました。本当に嬉しかったです。複雑な生体分子の構造がまだ見えない時代に、大沢先生は生きもの特有のことがあるに違いないと、独自のアイディアを提案し続けておられたわけで、長い歳月を超えてようやく原子レベルの構造が見え、論理的に検証できる時代に到達したことを喜んでくださったのだと思います。
私は今、日本電子と分解能をさらに向上させた究極のクライオ電子顕微鏡の開発を進めています。あらゆる生体分子を原子レベルで解析できるようにすることを目標に、結晶化することなく2 Åを超える分解能を目指しています。この顕微鏡から、生きものならではの、人工機械とは全く異なるしなやかなしくみが見えてくるはずだと期待しています。

大沢文夫先生の米寿を祝う会で柳田敏雄さん(右)と(本人:左)