アメリカ最先端の研究現場で/分子生物学の時代
1958年、会社からの派遣という形でオレゴン州立大学大学院細菌学科に入学、1年後にはカリフォルニア大学バークレー校大学院ウィルス学科に転学した。モレキュラーバイオロジー(分子生物学)という言葉が生まれたばかりの頃で、その第一期黄金時代だった。
バークレー校にはノーベル賞学者が10人はいた。分子生物学のパイオニアの一人、ステントが直接ファージの講義を情熱的にしてくれるのだから、わくわくもの。T4ファージを用いて遺伝子は一つのタンパク分子に対応することを明らかにし、さらに遺伝子マップを解析したベンザーの最新データを紹介してくれた。付属ウィルス研究所の所長は、タバコモザイクウィルスを結晶化させ、生物と無生物の間をつなぐ大仕事をしたスタンレー(1946年ノーベル賞受賞)。皆教科書に載るような名前だ。彼らから直接聞く話は初めてのことばかり。本当にすばらしかった。私の中でばらばらだった遺伝学、生化学、微生物学が一つに結びつき、時代は大きく変わっていることを実感した。そこで初めて、ああ、研究したいという気持ちが強く湧いてきた。
私の付いたフランケルーコンラット教授は、タバコモザイクウィルスのコートタンパクとRNA(このウィルスの遺伝子)を分離し、それを試験管の中で再構成することに成功した後、コートタンパクのアミノ酸配列決定を進め、さらにRNAの構造解析にチャレンジしようとしていた。私は、約6000塩基あるRNAの3′ 末端の塩基を決めるというテーマを与えられた。実験データをフランケルーコンラットのところへ持っていくと、彼はああでもない、こうでもないと考えながら一歩一歩着実にサイエンスを作り上げていく。サイエンスの面白さはこういうことなんだ、と感じ、彼が神様に見えた。その神様に怒られないように付き合っていたら、3’末端の塩基がアデノシンであることを決めるところまできて、普通5年はかかる博士課程を3年で終わっていた。遺伝情報をもつ核酸の末端塩基配列を決めた世界で最初の仕事で、私にとっては、快心の成果だった。
しかし、たった一つの塩基を決めるのに2年半!そのテンポでは、6000塩基決めるのに1万5000年かかる計算になる。そこでフランケルーコンラットは塩基配列決定法の開発が必要と考え、私は、今までの方法とはまったく違うものでなくてはならないという漠然とした考えはあったが、そういう開発には向いていないと思い、日本へ帰った。
タンパク質の分析法で58年にノーベル賞を受賞していたサンガーも塩基配列決定法の開発に転じており、フランケルーコンラットの研究室ではサンガーと一緒に議論したことも度々あった。そのサンガーが塩基配列分析法を確立したのが65年(RNA)と73年(DNA)、80年にはその業績でノーベル賞を再び受賞した。彼は、分子を壊して分析するのでなく、合成酵素を使って核酸を成長させるという生物が本来もっている機能を利用した。大きな発想の転換だった。

アメリカで。釣りの写真ばかり残っている。

バークレー校でお世話になったフランケルーコンラット博士夫妻。1981年の来日で再会。
ウィルスのコートタンパクがリプレッサーとしてはたらくことを証明した。
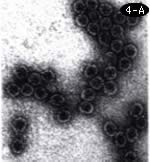
A)実験に使ったMRS2ファージ。この頭の部分を作っているのがコートタンパク。その中にRNAが入っている。
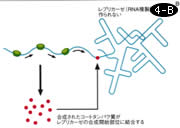
B)合成されたコートタンパク質が、レプリカーゼの合成開始部位に結合する。そうすると、リボソームがレプリカーゼのほうに行かなくなり、レプリカーゼが合成されなくなる。
再びアメリカへ
日本へ帰ってはきたものの、やはり分子生物学がやりたい。しかしそれは、アメリカでなくてはできない…。日本ではまだ、分子生物学ってなあにと言われる頃だったのだ。会社には義理を欠き、まことに申し訳ないと思ったが、結局1年半後、再びカリフォルニアに戻った。
当時、DNA→RNA→タンパク質という流れは解明され、遺伝子の発現に制御機構が存在するということを、ジャコブとモノーが大腸菌を使って遺伝学的に証明して、世界中を沸かせていた。あるタンパク質が必要でない時は、DNAにリプレッサーがついてはたらかないようにし、必要になるとリプレッサーがはずれてタンパク質の合成が始まるというモデルである。そこで、DNAに結合する分子が実際にあるのか、あるとしたら、それはタンパクなのか核酸なのかという、大問題が出てきたわけだ。
これこそ、分子のレベルで生物らしさを解く問題だ。私もこれに挑戦しようと思い、もっとも易しいシステムとして、遺伝子が3つか4つしかない大腸菌ファージMS2を選んだ。ファージのRNAをメッセンジャーとして試験管の中でタンパク合成をさせる時に、RNAにウィルスのコートタンパク6分子を結合させておくと、一部の遺伝子は正常に翻訳されるが、抑制されて翻訳されない遺伝子もある。コートタンパクが翻訳レベルのリプレッサーとしてはたらくことが証明できたのである。67年のこと。
じつはこれは、ワトソン、クリック、ジャコブ、モノーと引き継がれてきた分子生物学の主流のテーマで、我こそはと思う人がみな取り組んでいたのだが、それも知らずに、ほとんど一人でやっていたわけだから、無鉄砲もいいところ。遺伝子の分子レベルでの制御の最初の例になると思ったのだが、ギルバート(80年ノーベル賞受賞)が半年早く、しかも正攻法で成功していた。くやしかったが、私のは、その後たくさん発見される転写後制御の最初の例としてそれなりの評価を受けた。
ニューヨークのシンポジウムにも夫婦同伴の招待が来て、昼間の会議のあと、夜はパーティー、音楽会等、はなやかな世界をのぞき見て、大いに楽しむこともできた。しかし西海岸の有名大学で、2週間セミナーをして歩いたらくたびれ果てて、こんなことは二度としたくないと思った。大学院生の頃、ジャコブがアメリカ中セミナーをして回っているのをあこがれの気持ちで見ていたことを思い出しながら。
その頃、私はデュポンの研究所にいて、自分のテーマで研究しながら、抗ウィルス剤の開発チームのディスカッションの相手をするという義務を果たしていた。しかし、会社のプロジェクトが終了したころ、遺伝研からの誘いもあって帰国することにした。72年だった。

腔腸動物のヒドラは、大きさは平均5~10mmくらい。チクビヒドラ(写真=楚山勇)
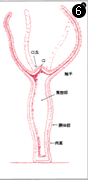
断面図。ヒドラの体は、2層に上皮細胞が並んでいるだけの単純な構造。再生力が非常に強く、細胞をばらばらにしても遠心器で集めると、再び完全な個体をつくる。
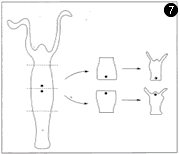
ヒドラの再生実験。切り取った部分の上のほうから頭が、下のほうから脚の部分が再生する。極性があることがわかる。
帰国/ヒドラの変異体を分離する
その頃から、競争はサイエンスの本質ではない、楽しみながら自分のサイエンスをしたいと思うようになった。もし自分がやらなければ、20年間は誰もしないというタイプの研究をしよう。うまく成功すれば新しいサイエンスの流れが出てくるような…。日本では、外国で確立された研究の日本支社を開くというのが一般的だったなかで、何をしようかと帰国して半年くらい考えた。
まず考えたのは、変異株を使って現象を追う方法を用いること。大学院に入った頃、大腸菌の変異体を使って、遺伝子のはたらきを調べる方法が出てきた。たとえば、細胞分裂できない変異株を解析して、細胞分裂のメカニズムを調べるのだ。これが分子生物学を作ったともいえ、この方法は大事だという気持ちがあった。
ただ、時代は動いて、その頃は分子生物学の第一期は終わりつつあり、多細胞生物を用いて、遺伝子のはたらきと発生学を結びつけるという新しい模索が始まっていた。ブレンナーはセンチュウを使って、受精卵から次々生じる体細胞をたどる(細胞系譜)仕事を始めていた。ヌスライン=フォルハルトは、発生に異常のあるショウジョウバエの変異体を組織的に分離する仕事を始めていた。
ある日、ヒドラが頭に浮かんだ。水の中でふわふわとはかなげに揺れている腔腸動物のヒドラは、ショウジョウバエに比べて形態がはるかに簡単だ。18世紀以来の実験生物学の伝統があり、多くの観察データが蓄積されている。ヒドラの変異株を分離した人はいない!変異株を使って再生の機構を明らかにしようと決めた。トランブレーに始まって多くの人が、その観察から再生機構についてのいろいろな説を唱えていたからだ。
72年に始めたこの仕事は、77年に最初の論文を出すまで5年かかったが、競争ではないからこれでよい。実体顕微鏡さえあればいいから、お金もいらないし。
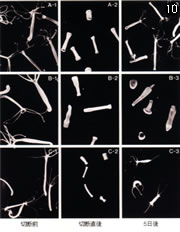
ヒドラで興味深い変異株がたくさん分離できた。その一つが頭を切ると再生できない株だった。普通、ヒドラは出芽という無性生殖によって増え、実験的に切ると体のどの部分も再生する。ところがこの株は、足は再生するが、頭は再生しないのだ。
そもそも頭の再生の仕組みは何か?これには位置情報理論というのがあった。ヒドラの体内には、活性因子と抑制因子があり、両者の釣り合いで組織が保たれている。頭を切ると傷口から抑制因子が外へ流れてしまい、活性因子の比率が高くなり、それがある一定レベルになると頭が再生する。これが野生型だが、変異株では活性因子に対する抑制因子の比率がかなり高く、切っても抑制因子の効果が低下しないという理論である。変異株を使った実験で、この位置情報理論は基本的な考え方として間違いないと言えるところまでいった。しかし、抑制因子と活性因子の実体はつかめていない。




博士の60歳の誕生日を祝って、ハンス・ボード教授(カリフォルニア大学アーバイン校)から贈られてきたグリーティングカード。ヒドラに付いている名前は、博士が分離した変異系統。大きさや形は、性質を示している。
ヒドラの再生と、異常な再生を示す変異体。
A)正常なヒドラ
B)頭を再生しない変異体
C)足の代わりに頭を再生する変異体。
分子生物学からヒドラへ
アメリカでの最先端の分子生物学研究から一転して、ヒドラという何とも古典的な生き物を対象に、一見単純な再生現象をテーマにすることになった。どうして?と聞かれることがあるが、じつは、世界的にもこういう転身をした研究者は少なくない。大腸菌を中心にした分子生物学の第一期の黄金時代が一区切りついた時、ベンザーはファージからショウジョウバエの発生の研究に変わったし、前にも触れたようにブレンナーはセンチュウに転じた。他にもヒルやワムシを材料にしようとした人もいた。そのなかで、ショウジョウバエやセンチュウは新しい流れを生み、それらは今、多細胞生物の分子生物学のモデル生物となっている。
自分で新しい系を作り上げていくのは、困難な道であることは確かだ。ヒドラでも面白い現象はいくつか捉えられたが、体系化は難しかった。最初に使っていたチクビヒドラの場合、遺伝解析をしてマップを作ることがまったく困難だったし、世代交代の時間が長く、近交交配すると死んでしまうなど不利な条件が多く出てきた。ヒドラが体系化に向いていないのか、展開のしかたに問題があるのか、まだ最終結論は出ていない。
博士が長年使ってきたのは淡水産のヒドラ(チクビヒドラ)だが、最近は近縁の海産カイウミヒドラを使って、受精卵からプラヌラ幼生になる初期発生と、幼生が親ポリプになる変態過程に対するペプチドの効果を調べている。写真は、変質直後のポリプの頭部に現われる神経系の蛍光顕微鏡写真。


ヒドラに夢を/ペプチドのシグナル分子
悪あがきでもいいから、もう一度、ヒドラを中心に新しい流れを考えてみたいと思っている。ショウジョウバエやセンチュウと違って、ヒドラは遺伝子マップを作りにくい。そこで考えた方法がペプチド性シグナル分子を中心とする研究である。ヒドラのペプチドはまだ十分に調べられていないが、人間を含む動物の体内で、ぺプチドはホルモンや神経伝達物質として重要なはたらきをしている。そこで、4~5年前から始めたのがペプチドプロジェクト。ゲノムプロジェクトを見習って、ヒドラの発生制御をするペプチド性シグナル分子を全部網羅的に調べてみようというわけだ。この方法でヒドラの発生を追うと、ショウジョウバエとはまた違う面が見えてくるかもしれないと思っている。
予備実験では、ヒドラの発生に関わる重要なはたらきをするペプチドが400種以上あることがわかった。その中から、たとえば、ヒドラの頭部再生の促進や抑制に明確な作用をもつペプチドが分離できたら面白いと思う。このペプチドの作用によってどの遺伝子が発現するかもわかるだろう。方法論はもう確立しているから、うまくいけば、再生の分子機構がこの2~3年には捉まえられる可能性はある。
アメリカでフランケルーコンラットやスタンレーを見て、流行に乗り遅れまいとするより、独自なことをしたいとずっと思ってきた。そして研究生活の後半は、ヒドラを通して、再生というテーマを追いながら、サイエンスを楽しんできた。ヒドラは私の研究を独自なものにし、ヒドラでなければできないサイエンスの新しい流れを作る可能性を与えてくれている。しかし一方で、ドイツやアメリカの共同研究者からも、早く成果があがらなければ研究費が取れず、発生学の材料からヒドラが消えるかもしれないという声も聞こえてくる。研究とは何かという本質的な問いがここにはある。そのような問題もあるので、愛すべきヒドラについて一冊まとまった本を書いておくべきかとも思う。しかし、石巻で始めたカイウミヒドラが毎日卵を産んでいるし、まだまだ実験の現場から離れられそうもないのが現状だ。時間があれば魚釣りにも行きたいし。夏が来ればもっぱらヒラメ釣りだ。

慶良間、阿嘉島でミドリイシ属サンゴの調査。

1日の調査が終わって。左からC.ウォレス博士(クィーンズランド熱帯博物館館長)、大森信教授(東京水産大学)、杉山博士、林原毅博士(当時阿嘉島臨海研究所)