偉人の生涯から医学研究に憧れて
生まれ育ったのは香川県善通寺市。讃岐平野の西端にある田園地帯で、お大師さん(空海)のふるさとです。小さい頃の遊び場はお寺や四国学院大学構内の原っぱ、そして田んぼの脇の用水路でした。香川県にはお大師さんが改修に関わったとされる満濃池など、灌漑用のため池がたくさんあり、そこから網目のように張り巡らされた水路は、いつも澄んだ水を湛えていました。雨が少ない地域なので、先人たちが水の確保に尽力してきたのですね。時々、水面から魚が泳ぐ姿をのぞいて楽しんでいました。生物学者には元昆虫少年やラジオ少年が多いですが、私は一つのことに夢中になるタイプではなく、家の近くで遊び回るのが好きなごく普通の子どもだったのです。
父は小学校の教師でしたが、読書や勉強を強制することはなくのびのびと育ててくれました。研究者を志すきっかけは、小学校の図書室での伝記との出会いです。人生をかけて難題に挑み、新たな地平を拓いた科学者や医師の物語に惹かれ、4、5年生の頃には「基礎医学の研究をする」と決めていました。今思うとベタな理由だなと少し照れくさいのですけれど。中学、高校では生物や化学、数学が好きで、授業で興味をもった分野の本をこまめに自分で買いに行きました。進路選択では迷わず、岡山大学医学部へと進みました。
小学生の時、友人と。この頃にはもう研究者になると心に決めていた。(本人:右端)
野球部で学んだチームプレイ
医学部の6年間で一番興味をもったのは3、4年の時の授業で生理学、病理学です。ヒトの体の成り立ちの素晴らしさと、症状の背後にある原理を通して、ヒトがどうして病気になるのかを考えられることに強い関心をもちました。それは、今でも同じです。
人生に大きな影響を受けたのは、大学の野球部での経験です。医学部のチームですから初心者でも楽しめるだろうと甘くみて入ったのですが、これが大誤算。練習は毎日あり、練習中は水も飲めない当時の体育会系の典型でした。特に3年生の時には、午後から夕方まで解剖実習をしてから練習という日々で本当にヘトヘトでした。さすがにもう、本気で辞めようと一週間ほど練習をサボっていたら同級生でエースだった陶山文三さん(故人)が下宿まできて「また明日から一緒にやろうよ」と声をかけてくれたのです。私はほとんど補欠でしたが、陶山さんはエースとして活躍するだけでなく周囲の面倒見がよく、練習でもたくさん助けられました。彼のおかげで6年間続けることができたと言えます。こうしてチームプレイの大切さを学んだこと、物事を継続できる体力を得た事が、研究でも生かされていると思います。
久世球場(岡山県真庭市)で同級生の陶山文三さん(右)と。厳しいチームで6年間続けられたのは、助けてくれる仲間がいたからだ。
真核生物の分子生物学の道へ
卒業が近づき同級生が臨床医としての進路を決めていくなか、私は進学先に頭を悩ませていました。当時、自分の中にあった関心は2つ。1つはがんのしくみです。1970年代前半はがんについてほとんど何もわかっておらず、解明の糸口すら見えていない時期でした。もう1つは、核酸(DNA、RNA)への興味です。日本でも分子生物学という分野が始まった時代であり、クリックが提唱したセントラルドグマ「DNA→(転写)→mRNA→(翻訳)→タンパク質」が頭の中にありました。タンパク質や脂質よりも上流にある生きものの基本情報、核酸を研究したい、そして、それがいずれがんの解明へとつながるのではないかと自分なりに考えていました。
当時の分子生物学の主流は大腸菌やファージを用いた研究でした。全生物に共通の基本原理を知るのには大腸菌は素晴らしいモデル生物ですが、がんなど高次の生命現象は見られません。大腸菌では目指している研究につながらないと思った私は、真核生物の分子生物学を学べる場を必死で探しました。日本ではそのような場はほんのわずかで、そのひとつ徳島大学村松正實先生(現・東京大学名誉教授、埼玉医科大学ゲノム医学研究センター名誉所長)の研究室の存在を知りました。ところが、その時すでに徳島大学大学院の試験は終わっていました。早めに大学院に向けて動いていればよかったのですが、情報も少なく間に合いませんでした。でも幸い私の思いを知った岡山大学の先生が、大学院2年目から村松先生の下で研究ができるように取計らってくださったのです。この時の先生方の支えがなければ、今の私の研究人生はありません。
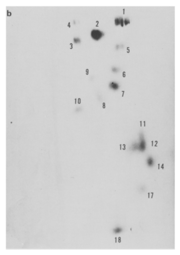
大学院では、マウスの細胞を用いてリボソームRNAのサブユニット28S、18S、5Sの塩基配列を解析しながらリボソームがどのように合成されるのかを探りました。当時は配列を自動で読み取るシーケンサーはありませんから、さまざまな分解酵素でつくったRNAの断片をSanger法Sanger法フレデリック・サンガー(Frederick Sanger)博士が開発したRNA塩基配列決定法。サンガー博士はタンパク質のアミノ酸配列決定法とDNAの塩基配列決定法も開発しておりノーベル化学賞を2度受賞している。で電気泳動し、スポットを手作業で読み取ってパズルを組み立てるように塩基配列を読み解いていきました(図1)。今ではあっという間にできることを、長い時間をかけて地道に解析していく時代でしたが、分子生物学の手法を身につけ研究者としての基盤を築けたので決して無駄な時間ではなかったと思っています。
ある時、研究室のセミナーに米国NIHのがん細胞培養の専門家、角永武夫先生(故人)がいらっしゃいました。角永先生は、ヒトの正常細胞に変異原となる化学物質を作用させてがん化させることに、世界で初めて成功した方です。培養の分野で最先端を走っていらした角永先生が、その技術と分子生物学を合わせてがん研究を始めたいと考え、村松先生に相談なさっていたのです。そこで私に声がかかりました。大学院で学んだ技術を活かして、がん研究への道が開ける! 学位取得後NIHへ行く決心をしました。

図1:大学院で取り組んだRNAの塩基配列解析。配列断片の電気泳動を繰り返して、1塩基ずつ地道に読み取っていた。
大学院生の頃。札幌で開催された生化学会後に村松先生(後列右端)と研究室メンバーで北海道旅行をした。(本人:後列左から3番目)
恩師の村松先生(左)が結婚式の仲人をしてくださった。困った事に、仲人の方が恰好いい。
がん研究から転写制御の解明へ
この頃、世界で初めてがん遺伝子が発見されました。がんは外来の物質だけで起こるのではなく、正常細胞に原因となる遺伝子がもともと存在することがわかったのです。角永先生の下に移った私はすぐに、がん細胞と正常細胞を比較してがん遺伝子を特定(クローニング)する研究を始めました。ところがその半年後には次々とがん遺伝子が発表される世界的な競争時代に突入して行ったのです。競争は急速に過熱し、やがてヒトゲノム計画にもつながる分子生物学のメインストリームとなっていきました。
そんな中、私たちの研究室ではがん細胞に正常細胞と異なる型のアクチンタンパク質があることを見つけ、そのクローニングを行っていました。アクチンの変異ががんの原因ではないかと予想したのですが、残念ながら直接の関係はないとわかりました。細胞をがん化させるために変異原を加えるとさまざまな遺伝子に変異が入り、たまたまその一つがアクチンだったのです。
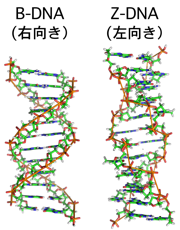
アクチンの研究は、がんの原因を探る道にはつながらなかったのですが、その後、予想外の方向に展開していきました。私はクローニングしたアクチンの塩基配列の中にTとGをくり返す不思議な配列があることに気がついたのです。調べてみるとMITの高名な生物物理学者アレクサンダー・リッチ(Alexander Rich)博士が「Z-DNA」(図2)と名づけた、通常とは逆向きの左巻きの構造をとる配列だとわかりました。試験管の中の合成DNAで発見された構造を、生きた細胞の中に見出したのです。これは重要な発見だと興奮しました。大勢の人が同じゴールを目指す熾烈ながん研究の様相に圧倒され、私は面白い生物学的現象を見出すことで個性が出せる研究をしたいと思っていたので、目の前の現象から何か糸口を掴みたいと必死で考えました。
DNAの立体構造の変化は、さまざまなタンパク質がDNAに結合することによって進む転写反応に影響を与えるのではないか。私はここで、左巻きDNA配列が転写量を大幅に上げるエンハンサーの役割をすると予想しました。当時、ウイルスゲノムにエンハンサーがあることはわかっていましたが、真核生物の転写制御はほぼ手つかずの分野でした。そこで、ヒト由来の培養細胞であるHeLa細胞をつかった実験系を自分で作るところから始めました。まず、薬剤耐性をもつ遺伝子に、弱いプロモーターだけをつけたものと、さらに左巻きDNA配列もつけたものとをHeLa細胞に挿入し、薬剤を添加した培地で育てます。弱いプロモーターだけの場合は薬剤耐性タンパク質がほとんどつくられないために生きられず、左巻きDNA配列を加えた場合にはタンパク質の転写量が上がって生き残り増殖できると予想したのです。しかし、予想はハズレ、どちらの場合もコロニーが1、2個だけ出るのです。左巻きDNA配列の有無では転写量は変わらないとわかりがっかりしました。でもどちらの場合にもコロニーがわずかにできることがひっかかりました。そして生き残ったコロニーは、薬剤耐性遺伝子がたまたまゲノム中のエンハンサーの近くに挿入されたために薬剤耐性が上がったのではないかと考えて研究を続けました。当初の目論見ははずれましたが、これは正しい考え方で、ヒトゲノムの中のエンハンサー領域を探索する、エンハンサートラップの実験系を作ることができたのです。予想を裏切る結果に出会った時こそ生きものから学ぶ好機です。自分の考えを超えた現象がそこにあるわけですから。
NIHに在籍して4年目、事務手続きで大きなミスをしてしまいました。研究生活に集中しているうちに、雇用の契約期限が切れてしまったのです。大変弱りましたがしかたがありません。NIHに「無給でもいいから研究を続けさせてください、ただし、好きなことをやらせてください!」と交渉しました。幸い当時のNIHは財政状況がよかったこともあり、研究費つきで在籍が認められました。自分でつかんだ研究の活路、エンハンサートラップを無駄にせずにすんだのですから、本当にありがたいことです。
NIHでの成果をもって、次の研究先を米国内で探し始めました。先端の技術力をいかして活躍する角永先生に憧れ、海外で独立した研究室をもつ目標をたてたのです。論文の数もある程度ありましたので、アシスタントプロフェッサーにはなれるだろうと勝手に思いこんでの行動です。ところが100件以上の求人に応募して5箇所ほど面接に行った結果はすべて不採用です。すでに、妻子がいましたので悩みました。「これが最後。もしダメだったら日本に戻って臨床医になろう。」そう心に決めて挑んだカナダのメモリアル大学の面接で、ようやくアシスタントプロフェッサーの仕事が決まったのです。あの時は本当に嬉しくて、捨てる神あれば拾う神あり、真面目にやってきてよかったと心底思いましたね。面接で不採用続きの時は、焦りばかりがつのって自分に何が不足しているのか客観的にわからずにいたのですが、振り返ると当時の私は英語のレベルが低くそれが大きな足かせとなっていたのです。NIHは日本人が多く、研究室のリーダーも日本人ですから英語を使おうと心がけても、つい日本語での生活が多くなっていました。メモリアル大学はカナダの片田舎、ニューファンドランドにあり学内の日本人は私一人でしたので、3年間の生活が英語の上達にもつながりました。のどかな地域での生活を妻と幼い子どもと楽しむことができたのもよい思い出です。
メモリアル大学でエンハンサートラップの成果が実り、ヒトゲノムの中にエンハンサー領域があることを証明できました。HeLa細胞で実験がうまくいったので、次に未分化幹細胞の性質をもつEC細胞EC細胞胚性腫瘍細胞(embryonal carcinoma cell)。マウスの腫瘍細胞から樹立された多分化能をもつ細胞株。を使った実験に挑戦しました。このきっかけは、カナダのオタワ大学でEC細胞培養を行っていたマイケル・マクバーニー(Michael McBurney)博士と出会ったことです。EC細胞は神経や筋肉などさまざまな組織細胞に分化することができる細胞です。運命が決まっていない細胞が多能性を維持するしくみを探るため、EC細胞と分化細胞でエンハンサートラップを行い比較しました。そして細胞が未分化な時にだけ活性化するエンハンサー領域を見つけたのです。
NIHにて角永先生(右)と。若かったので自信過剰になっており先生にも随分、生意気な発言をしてしまったが、6年間研究を支えてくださった。
図2:DNA二重らせんの立体構造。生きものの体内でもっとも多いのは右向きのB-DNAである。(出典:Wikimedia Commons)
メモリアル大学の同僚たちと。初めて独立した研究室をもち、自分のテーマを自由に研究することができた。(本人:後列左から2番目)
カナダの自宅前で。のどかな地域での生活を家族で楽しみ、またいつか戻りたいと思うほど充実した日々だった。
Oct3/4の発見と研究の転換点
カナダでの研究生活は順調で、このまま永住しようと考えていましたが、1988年、村松先生にお声がけいただき東京大学医学部生化学教室に助教授として帰国しました。村松先生の退官の時期が近づいており、恩師の下で研究ができる最後の機会かもしれないと考えての決断です。東大ですから、研究環境はそれなりに整っているだろうと思って帰国し、驚きました。当時の日本の設備は米国やカナダに比べてかなり劣るものだったのです。帰国したのは失敗だったのではないかと弱気になりましたが、村松先生は「私の研究とは切り離して君の好きなことをやりなさい。」とおっしゃって優秀な学生さんを私のグループに入れてくださいました。岡本康司さん(現・国立がん研究センター分野長)、岡澤均さん(現・東京医科歯科大学教授)らです。彼らと出会えたことで日本に帰ってきてよかったと心から思えました。研究するうえで設備は重要ですが、一番大事なのは人ですから。
カナダで見つけた未分化細胞に特異的なエンハンサーを活用し、その配列に結合する転写因子を探し始めました。そして98年に未分化性を維持する転写因子Oct3/4を発見したのです(図3)。今では、細胞の初期化を誘導する山中因子山中因子4つの遺伝子Oct3/4、Sox2、Klf4、c-Myc。これらを特定の細胞に分化した体細胞に導入することで、多能性をもつiPS細胞を作り出すことに山中伸弥博士(京都大学iPS細胞研究所所長)らが2006年に成功した。の一つとして有名です。実は、私たちが発表した時につけた名前はOct3でした。その後、数ヶ月遅れて同じ遺伝子をドイツのグループがOct4として発表し、そちらの勢いが強くOct4の名前が世界的に定着していってしまったのです。私たちは次の研究へと展開していったので名前を主張することはしませんでした。当時は転写因子を探す競争時代の只中だったのです。

その後も培養細胞を用いて遺伝子のはたらきを追う実験を続けていましたが、次第に息苦しさを感じるようになりました。この頃、世界では遺伝子改変マウスの実験系が確立し、培養細胞による成果で重要だと思われていた遺伝子を生体で欠損させても、何も起こらないという例が出始めたのです。私が知りたいのは生きた体の中で起こる生命現象です。必死に追いかけて見つけた現象が、シャーレの中でしか起こらないものだったとしたら、それは、ある日突然自分が見ていた景色がガラガラと崩れてしまうのと同じだと思いました。研究の転換が必要ではないかと悩んでいた時、来日したシドニー・ブレナー(Sydney Brenner)博士の講演を聞きました。ブレナー博士は体長わずか1mmほどの小さな土壌動物、線虫(C. elegans)を分子生物学の新たなモデル生物として取り上げ、発生や行動など高次機能を解明する研究を樹立した鬼才です。彼はその時の講演で「遺伝学を使わない生物学を信用するな!」と発言していたのです。極論ではあるが、一理ある。この発言に後押しされた私は、個体を用いた遺伝発生学への挑戦を決めました。今思えば、この選択が動物の形づくりの本質に迫る研究へとつながったのです。
図3:Oct3/4を発見した時の実験結果。カナダで見つけたエンハンサー領域を手がかりに、核酸とタンパク質の結合を調べる実験系ゲルシフトアッセイを行い、未分化性を維持する転写因子を見出した。Okamoto K, Okazawa H et al., Cell. 1990 Feb 9;60(3):461-72.より引用。

東大・医・生化学時代、勉強会も兼ねた(!)村松研究室のラボ旅行。(村松先生:右から2番目、本人:左端)
偶然から始まった左右軸決定機構の研究
村松先生の退官後、私は臨床研に移り培養細胞を用いた遺伝子探索と、マウスの個体を用いた実験とを組み合わせた研究を始めました。まず、発生初期に重要な役割をする遺伝子を見つけるため、未分化細胞と分化細胞のDNAの網羅的な比較解析と、Oct3/4の下流遺伝子の探索を進めました。見つけた遺伝子はすべて塩基配列を決めていき、そのうち重要な配列をもつものはマウスの胚を用いて発現パターンを確認していく戦略です。マウスの胚を扱う実験は鍋島陽一先生(現・先端医療振興財団先端医療センター長)に教えていただき、研究員の西條幸男さん(現・ユタ大学特任准教授)と学生だった目野主税さん(現・九州大学教授)が担当しました。この二人が発生学の技術を確立してくれたおかげで研究室の礎を築くことができました。
解析を進めていく中で見つかった遺伝子のひとつが、細胞の分化や増殖など多様な機能を担うTGF-βスーパーファミリーTGF-βスーパーファミリー共通の構造上の特徴をもち、細胞膜の受容体に結合する分泌性タンパク質のグループ。哺乳類では約40種類が報告されている。アクチビンやBMP(骨形成タンパク質)などもここに含まれる。に属することがわかりました。これは重要なはたらきをしているに違いないと考え、早速、胚での発現を見ました。すると初期胚(受精8日目)の左側だけで発現している様子がはっきりと見えたのです。このような発現パターンはそれまで1度も報告されていません。すぐに重要な遺伝子だと気づきLeftyと名づけました。
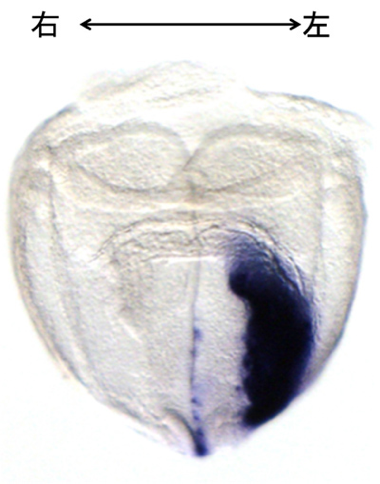
受精後8日目マウス胚でのLeftyの発現
動物の始まりである卵は対称ですが、発生過程で頭尾、背腹、左右という3つの体軸ができ、非対称で複雑な形ができていきます。私たちのからだの器官は、心臓や胃は左、肝臓は右というように非対称に位置していますが、それを生み出す左右軸が発生初期にどのように決まるのか、当時は全くわかっていませんでした。私たちはその解明の糸口となる遺伝子を見つけたのです。実は、Leftyが左右非対称に発現するのは、発生過程の中のごくわずかな5〜6時間ほどだということが後でわかりました。最初の実験でLeftyの非対称な発現をとらえたのは偶然この時期を見ることができたからだったのです。研究には運も必要です。
Leftyを『Nature』に発表したのは最初の発見から2年後の96年です。この間、谷口維紹先生(現・東京大学特任教授)の後任として、大阪大学細胞工学センターに移りました。阪大に移って一番よかったことは、なんといっても近藤寿人先生(現・京都産業大学客員教授)の近くで研究ができたことです。近藤先生はES細胞ES細胞胚性幹細胞(embryonic stem cells)。動物の発生初期段階である胚盤胞期に、胚の一部である内部細胞塊を取り出して培養された細胞株。体のあらゆる細胞に分化する性質をもつ。からノックアウトマウスを作製する希少な技術をおもちでした。目野さんが技術を習い、Leftyのノックアウトマウスの作製に成功し、見事に生体に左右性の異常が出ました。しかし、よく観察すると予想と矛盾する点が見えてきました。私たちは両側に右の特徴があらわれると考えていたのですが、結果は逆で両側に左の特徴があらわれたのです。このパラドクスにはしばらく頭を悩ませることになります。

臨床研時代の1枚。ベテラン研究者が揃っている部門の部長になり、最初は戸惑ったがマネジメントを勉強する機会になった。(本人:最後列右)
阪大にて研究室立ち上げの準備をしている時。谷口先生のグループの方々が掃除を念入りにして、綺麗に研究室を引き継いでくださったのが印象的だった。
阪大へ移った頃。目野主税さん(3列目左)がノックアウトマウスの作製、西條幸男さん(最前列右端)が転写制御の解析とそれぞれ分担して研究室の実験技術の基盤を築いてくれた。(本人:最前列右から2番目)
アクセル役とブレーキ役の見事な連携
ノックアウトマウスの作製と並行して、研究室では西條さんが中心となりLeftyの転写制御の解析を進めていました。この研究でも近藤先生に生体を使った実験系を教えていただきました。発生は多数の遺伝子の転写が複雑に制御されて進んでいきます。発見した遺伝子の機能を知るだけでなく、それがどのように転写されているのかを見なければ、発生過程で何が起きているのかを本当の意味で知ることはできないのです。当時、そのような視点をもつ発生生物者がほとんどいない中、近藤先生は着実に転写制御を解析する技術を開発しておられたのです。この実験ができなければ私たちの研究は行き詰まっていたと思います。
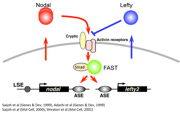
研究が進むと、左側を決定するのはNodalというタンパク質で、Leftyはそのはたらきを阻害する因子だということがわかってきました。転写制御の解析から、NodalとLeftyは共通のエンハンサー領域をもつことが明らかになりました。しかも、そのエンハンサー領域に結合するのはNodalが転写調節しているFoxH1(FAST)という転写因子なのです。Nodalタンパク質が細胞の受容体に結合すると、その細胞内でのNodal自身の発現を誘導し、一気に発現が活性化されます。それと同時に発現を抑制する因子Leftyの発現も誘導し、やがて一定時間内にどちらの発現も消失していくのです。アクセル役とブレーキ役が調節しあってわずかな時間だけ非対称な遺伝子発現があらわれることがわかりました(図4)。LeftyがはたらかないとNodalの発現を左側だけに限定することができないこともわかり、ノックアウトマウスで見られたパラドクスが解けました。また中村哲也さん(シカゴ大学へ留学中)は数理科学を導入して、NodalやLeftyの遺伝子発現が非対称になる原理を明らかにしました。異なる学問を取り入れる事で、視野が大きく広がる事を実感できた機会でした。
解析の過程で、NodalとLeftyは左右軸の決定以外にも使われていることが明らかになってきました。そのひとつが頭尾軸の決定です。Leftyには1と2がありますが、Lefty2をノックアウトすると左右軸の決定よりも前に胚がおかしくなっていることに気づいたので、初期段階の胚の観察へと時間を遡っていきました。そして体軸の中でもっとも初期にできる頭尾軸の決定にたどりついたのです。山本正道さん(現・京都大学特任講師)、高岡勝吉さん(ドイツへ留学中)らが解析を進めました。一定時間だけ一気に発現を活性化してすぐに消失するNodalとLeftyの組み合わせは、とてもよくできたしくみなので、発生過程のさまざまな場でくり返し使われているのでしょう。
近藤寿人先生(左)と。阪大での先生との出会いがなければNodal-Leftyの複雑な制御は見えなかっただろう。
図4:アクセル役のNodalとブレーキ役のLeftyが互いに調節し合いわずかな時間だけ一気に発現が活性化する。
ノード流の発見に受けた衝撃
左右で遺伝子発現の違いが生まれるのには、何かきっかけがあるはずです。これは遺伝子の解析だけでは見えないことでした。少し話が遡りますが、98年に生涯で一番影響を受けた論文に出会います。非対称な遺伝子発現が始まる前に、胚の腹側にある小さなくぼみ(ノード 図5)の表面を覆う繊毛が一斉に回転し左向きの水流「ノード流」ができるというのです。東大の廣川信隆先生(現・東京大学特任教授)、野中茂紀さん(現・基礎生物学研究所准教授)らの発表で、非対称の始まりを知る重要な成果です。私は分子や遺伝子に集中しすぎていたと気づき、細胞や胚全体を見ることの大切さを学び、
ノード流が本当に左右軸形成に関わっているのかを知るため、私たちは人工的な水流のもとで胚を培養する実験に挑戦しました。野中さんは装置作りが得意で普通の研究室にあるポンプなどを活用して5万円くらいで実験系を完成させました。目野さん、西條さんらが胚の扱いを熟知していたので、その知識を装置づくりに生かせたのも私たちの強みでした。誰もが思いつく単純なアイディアなのに、競合する研究室の人は誰もやらなかったのですから。そして、ノード流を逆転させることで生体の右左を逆にすることに成功した時は、やったと思いましたね。ノード流が左右軸決定の引き金であることを証明できたわけですから。これは論文の査読者にも大いに褒めてもらえました。低コストでしたから、費用対効果抜群の成果です。
これをきっかけに、研究の重点を遺伝子の解析から繊毛へと移していきました。繊毛の回転によって生じる水流が、なぜ渦にならず一方向の流れになるのかを探るため、流体力学が専門の工学部の先生に野中さんと相談に行きました。教えを参考に、繊毛の構造と運動を精密に観察したところ、繊毛の回転軸が尾側へと傾いていることが見つかりました。流体力学的な予測と見事に合致する結果です。繊毛が傾いて回転していると、細胞表面に近い半周で生じる水流の力が、表面から遠い半周で生じる力より小さくなるために打ち消され、結果的に水流が渦にならず一方向になるのです。
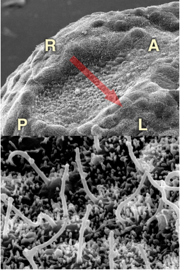
そこで、繊毛の傾きが揃う過程を橋本昌和さん(現・大阪大学助教)らと追いました。注目したのは、繊毛の根元にある細胞小器官、基底小体です。ノード内にある細胞の基底小体の位置は、最初は細胞ごとにバラバラです。ところが、発生が進んでいくと次第にすべての細胞で尾側に移動していくのです。先に決定している背腹、頭尾軸を活用して、数百本の繊毛の位置と傾きが揃うと自ずと回転が始まり、左右の対称性が瞬時に破られるのです。なんとよくできたしくみだろうと、知れば知るほど感心します。実は、ノードという構造自体も1日くらいで消えてしまう一過性のものなのですよ。
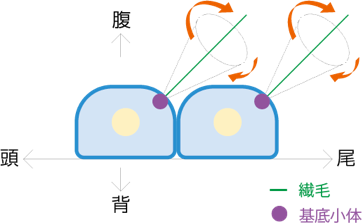
繊毛の回転から左向きの水流ができるしくみ
気管や脳室にある繊毛は波打ち運動をしますが、ノードの繊毛は回転運動をします。どうして動きに違いが生じるのかを、東大工学部から来てくれた篠原恭介さん(現・東京農工大学特任准教授)が追い、繊毛の構造の違いが原因である事を見つけました。運動する繊毛は基本的に、2本の微小管を9本の微小管が取り囲む「9+2」とよばれる構造をもちますが、ノードの繊毛は中心の微小管がない「9+0」構造です。中心構造を失っていることが、回転運動に関わっていたのです。しかし、ノードの繊毛がなぜ時計方向に回転するのか、この問いはまだ解けていません。
図5:(上)胚の腹側表面にできるノード(下)ノードを構成する数百の細胞に1本ずつ繊毛が生えている。
学会でリスボンを訪れた時の一枚。詩人フェルナンド・ペソアが常連だったという老舗クラシックカフェにて彼の銅像と記念撮影。
2003年の研究室のお花見。この頃、メンバーが一番多かった。(本人:最前列右から3番目)
マウス初期胚で発生の遺伝的制御を追うジャネット・ロッサン(Janet Rossant)博士(最前列中央)が研究室に来てくれた時の一枚。(本人:最前列左)
シドニーで開催された国際発生生物学会の後、哺乳類の発生過程の転写制御が専門のエリザベス・ロバートソン(Elizabeth Robertson)博士と。発生生物学の研究者には、頼もしい女性が多い。
ノード流の役割とは
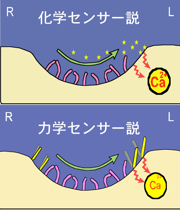
ノード流から細胞がどのように情報を受け取っているのかについて、大きく2つの説があります(図6)。水流によって運ばれる分泌タンパク質などを受容しているという化学センサー説と、水流の力を感知しているという力学センサー説です。直感的には前者の方が想像しやすく発生生物学者の大半はこちらを支持してきましたが、私たちは自身の観察に基づき後者だと予想してきました。解明が難しい問いですが、吉場聡子さん(現・国立遺伝学研究所研究員)が8年間この研究を続け、ついにノードの脇にある動かない繊毛が水流の力を感知している有力な証拠をつかみ2012年『Science』に発表しました。ノードの真ん中で水流が生まれ、脇の細胞がその力を感知すると細胞内の特定のmRNAが分解されるという道筋が見えてきたのです。証明はまだ半ばですが、大きな一歩を歩み出せました。

発生の過程では、ノード流が非対称な遺伝子発現パターンへとつながり、やがて胚に非対称な形があらわれてきます。繊毛の研究と並行して器官の形づくりを追い、白鳥秀卓さん(現・京都産業大学教授)、八代健太さん(現・大阪大学特任准教授)らが心臓から出る大きな血管(大動脈弓)が左側へと弯曲するしくみを明らかにしました。発生初期にいったん左右対称に動脈がつくられた後、Pitx2という遺伝子のはたらきによって、心臓から出る大血管が頭尾軸に沿って回転し、その結果、右側部分だけが細くなり細胞死を引き起こし消失するというしくみです。Pitx2はNodalによって制御されて左側だけで発現する遺伝子です。NodalとLeftyの発現は一時的ですが、Pitx2は非対称な発現を続け、器官の形づくりに重要なはたらきをしているのです。非対称の始まりである小さな水流から器官の形づくりまで、階層を超えて問いに挑むことができたのは、得意分野の異なる多様なメンバーが研究室に集まってくれたおかげです。
図6:ノード流から細胞がどのように情報を受け取っているのかを説明する二つの仮説
2011年の研究室のお花見。(本人:最前列右から2番目)
クリフォード・テイビン(Clifford Tabin)博士(右)が研究室に来てくれた時の1枚。テイビン博士は分子遺伝学と実験発生学の手法を組み合わせて脊椎動物の発生のしくみを追っている。
シドニー大学でマウス胚のパターン形成を探っているパトリック・タム(Patrick Tam)博士(中央)が来日した時、京都を案内した。発生学の大先輩だが、年齢は私よりも若い。
ドイツのヒト繊毛症の専門家ヘイムート・オムラン(Heymut Omran)博士(後列左から3番目)のもとを訪れた時。(本人:後列中央)
テキサスで開かれたゴードン会議の後、オムラン博士との1枚(2015年)。カマロ・コンバーチブルで爆走。今でも共同研究をする仲間。
本当に大事だと思う問いに向き合い続ける
研究人生を歩んで40年。若い頃はすべて自分で実験ができましたが、研究人生の半ばで新たな分野に挑戦したこともあり、実験技術の変化と複雑化のなかで、次第に自分一人でできることが少なくなっていきました。一人一人の興味や得意分野を活かしながら、チームとして問いに向き合うことで、大きな仕事を成し遂げることができるというのが私の実感です。
研究室から独立していく人たちには必ず「焦らず弛まずに」と声をかけます。新しい場に移ると、それまでのやり方が通用しなかったり、早く成果を出したいと焦ってしまうことが多々あります。それはしかたのないことですが、成果を焦ってつまらない問題に手を出すのはいけません。研究者にとって大切なのは、本当に大事だと思う問いに向き合い続けることです。私は熾烈な競争で勝ち残る瞬発力のある研究者ではありませんでしたが、その分、自分のペースで研究に向き合ってきました。だからこそ、非対称性のテーマと出会い、それを追い続けることができたと思っています。研究社会では、短期間で成果を求める傾向が強くなっていますが、若い人たちが自分の思いを貫き、じっくりと問いに向き合える時間と場所を守らなければいけません。
2016年に21年間勤めた阪大を退官し、理化学研究所多細胞システム形成研究センターへ移り新しい研究室を持つ事が出来ました。今は繊毛が動くしくみや、繊毛から信号が入った後の細胞内の変化などを追っています。いずれも難問ですが、これからも焦らず弛まず問いに向き合い続けます。

恩師村松先生の喜寿のお祝い。研究人生の扉を開いてくださった村松先生には長きにわたりお世話になった。
阪大を退官する時の研究室メンバー。全員新たな活躍の場が決まったことが、本当に嬉しかった。
NIH時代に手続きミスで1年半無給になってしまった時も、妻が支えてくれた。