年度別活動報告
年度別活動報告書:2009年度
脊椎動物の頭部神経はどのように部域化されるのか
橋本主税(主任研究員) 小倉絵里(奨励研究員)
皐 裕美(研究補助員)
川辺実季(大阪大学大学院生)
はじめに
脊椎動物の咽頭胚は、その形状が種を超えて高度に保存されている。これはとりもなおさず咽頭胚つくる仕組みに普遍的な仕組みがあると考えられ、また穿った見方をすれば、その普遍性こそが脊椎動物の脊椎動物たるゆえんであろうと考えられる。脊椎動物の胚発生を受精卵から見ていくと、卵の大きさや形、あるいは細胞分裂様式など種によって様々であり、そこに見かけ上の普遍性は見いだせない。しかし、それら形態的にも多様な胚が原腸形成過程を経る事により咽頭胚を形づくること、さらには原腸形成過程に関わる遺伝子が種を超えて保存され、またその形態形成運動にも相同性が見いだせると考えられている事などから、原腸形成過程が脊椎動物の形づくりにとって最も重要であると予想される。
私たちは、脊椎動物のかたち作りを知るためにアカハライモリ(以下イモリ)とアフリカツメガエル(以下ツメガエル)を実験材料として研究を行なっている。今年度に行なった研究としては、第一に、両生類の原腸形成機構を知る為の準備としてイモリの初期発生過程の詳細な解析、第二に、ミトコンドリアに局在し細胞内環境の制御に働くと考えられているUCP2遺伝子が神経の形成にどのように関わるのかに関してである。さらに、初期神経胚の神経板境界領域に発現が認められる、新規遺伝子を単離しその発現パターンを解析したので、これについても簡単に紹介する。
結果と考察
(1)両生類の原腸形成運動の解析
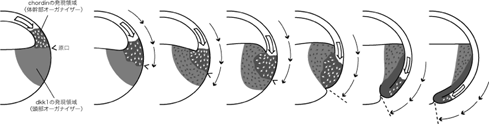
| この研究は、これまで長い間「同じ」であると考えられて来た両生類の原腸形成過程が、少なくともイモリとツメガエルを比較する限りにおいて、実はかなり異なっているという私たちの発見に端を発している。少なくとも原腸形成運動の方向を見る限り、イモリとツメガエルでは正反対であり、その相違点は、この20年の間ツメガエルを用いて得られた膨大な分子の結果を再考する必要性を投げかけている。さらに私たちは、近縁であるにもかかわらずこれだけ異なるイモリとツメガエルの原腸形成過程を詳細に比較検討することにより、脊椎動物に潜在する原腸形成機構の普遍的仕組みについて知ることができると考えてこの研究を進めている。 原腸形成過程の研究はいくつかの過程に分けての検討が必要であろう。たとえばオーガナイザーが形成される時期と場所、オーガナイザーの働き、原腸形成運動、神経誘導の時期と場所など、イモリとツメガエルの間ではかなり異なっていると考えられる事象が多く、それらをまとめて解析する事は問題を無駄に複雑にすると考えられるからである。今年度は、これらの点についてイモリとツメガエルの実験材料としての問題点やこれまで蓄積されて来たデータの性質などを詳細に検討し、これからの実験の準備となる基礎的なデータを予備実験的に集める事を行なって来た。 まず、実験発生学的な理解としてツメガエルのオーガナイザーはイモリやその他の両生類のオーガナイザーと基本的に同じであるとして議論が進められて来たが、実際に実験を行なってみると、ツメガエルのオーガナイザー活性を示す領域は原腸胚の極めて早い時期の特定の領域にしか存在しない事が明らかとなった。したがって、一般に「初期原腸胚」と呼ばれる胚の多くで原口背唇部には完全なオーガナイザー活性がツメガエルでは存在しないことが多い。この事実を理解する為に、頭部オーガナイザーと体幹部オーガナイザーに発現する事が知られているマーカー遺伝子の発現を指標にそれぞれの領域が形成される仕組みを追った。すると、体幹部オーガナイザーのマーカーであるchordin(Sasai et. al., 1994)の発現は当初は胞胚腔の屋根の部分に始まり、その発現領域が覆いかぶせ運動により赤道面へと降りてくる事が明らかとなった。また、頭部オーガナイザーのマーカーであるdkk1(Glinka et. al., 1998)はかなり植物極寄りの広い範囲にその発現が始まり、それが覆いかぶせ運動とベジタルローテーションによって赤道面へと限局する事が分かった。さらに、体幹部オーガナイザーは赤道面よりもさらに植物極寄りに下り、頭部オーガナイザーは胞胚腔の床の部分へと上る運動が続き、これら両者が偶然に出会う時期と場所が、ツメガエルにおける完全なオーガナイザー活性を示す領域と一致する事が明らかとなった(黒田私信)。脊椎動物を通じて、頭部オーガナイザーと体幹部オーガナイザーはその由来も完全に異なり、また物理的に互いに離れて存在する事が知られているが、今回得られた結果は両生類でも同様である事を示す。
シュペーマンらによる原口背唇部の移植実験では、移植された胚の腹側に頭部から尾部までの組織をもつ二次胚が誘導されるという結果となった(Spemann and Mangold 1924)。しかし、少なくともツメガエルにおいては上述したように初期原腸胚では原腸形成運動により刻一刻と細胞の位置や性質が変化していると考えられる。そのため、移植のための組織を切り出す、または組織を移植するタイミングによって、誘導される組織は変わる。また、オーガナイザーは一様な活性をもった組織ではないので、背側帯域の中でも取り出す部位を細分化することで、移植片のもつ誘導活性は異なってくる。そこで、イモリとツメガエルそれぞれについて、移植片と移植の結果誘導される組織の関係を詳細に調べ、オーガナイザーのもつ誘導活性の時間的変化や領域による違いを明らかにする実験を遂行した。まず、ステージ10.25のツメガエル胚からオーガナイザーを含む背側帯域を切り出し、同じくステージ10.25の別の胚の腹側帯域へと移植した。その結果、頭部組織(目、セメント腺)と体軸の誘導が観察された。これは過去に報告されたイモリやツメガエルによる原口背唇部の移植実験と一致する結果である(Spemann and Mangold 1924、De Robertis and Kuroda 2004)。次に、背側帯域を動物-植物極の軸に対して垂直に二つの部位に分け、それぞれの領域を別の胚の腹側帯域へと移植することで、部位の違いによる誘導活性の違いを調べた。これまで報告されている遺伝子発現のパターンから、動物極側の移植片では、cerberus(Bouwmeester et. al., 1996)やdkk1などが発現しており、これらの因子は頭部神経の誘導に関わるとされている。一方、植物極側の移植片では、chordinやnoggin(Smith and Harland 1992)などが発現しており、後脳や脊髄を誘導する活性をもつ。これらのことから、動物極側の移植片からは頭部が、植物極側の移植片からは体軸が誘導されると考えられた。移植実験の結果、それぞれ予想される組織が誘導されている胚が多く観察されたが、頭部と体軸の誘導を明確に分けることは現時点でできていない。考えられる理由としては、原口が入る瞬間のステージ10からステージ10.25の間で、細胞はダイナミックに移動しており、chordinやdkk1を発現している細胞群もまたその位置を変えていると考えられる。ステージ10.25の胚を厳密に見極めることが難しく、頭部と体幹部の誘導活性をもつ領域を移植片で分けることができていないものと思われる。実際に、オーガナイザー移植実験の文献等を読むとイモリとツメガエルの違いを目の当たりにする。これがオーガナイザー自体の活性の違いに起因するものなのか、それとも移植される胚の問題なのかについてはこれから解析を進めたい。発生の時間が著しく異なる為に実現可能性は低いだろうが、イモリとツメガエルにおいて互いのオーガナイザー領域を異種間移植することで、なにか新しい事が分かる事を期待している。
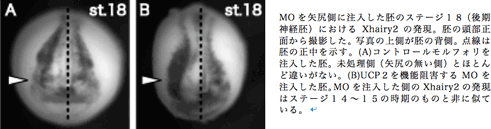
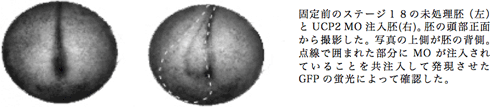
(2)初期発生におけるミトコンドリアタンパク質UCP2の発現パターンと神経発生における役割 脊椎動物の脳は終脳・間脳・中脳・後脳といった領域に分かれているが、これらは脳の構造ができる前の発生の非常に初期の段階(初期原腸胚)でおおまかに決定されている。この領域の決定にはさまざまな転写因子が関わっており、それらが領域特異的にカスケードをつくることで各領域が特徴づけられる。このことから脳の領域決定においては転写因子が各領域のマーカー遺伝子として非常によく研究されている。(Sasai, 2001; Wigle and Eisenstat, 2008)
UCP2の機能自体が未だ全体として明らかになっていない。今回の結果がどのような機序で起こったのかを解析することで成体や培養細胞を用いた研究とは違った面からUCP2の機能を解明できると期待している。
(3)神経堤とプラコード形成を制御する機構について私たちはこれまでに、脊椎動物を規定するともいえる神経堤とプラコードの形成機構について解析を進め、転写因子のカスケードではなく、細胞周期の状態を制御する事により神経堤とプラコードが形成されることを明らかにして来た(Nagatomo and Hashimoto, 2007, Murato and Hashimoto 2009) 。この考え方の主となる点は、神経板と表皮の運命が決まる時(ツメガエルでは初期原腸胚)において、神経と表皮の境界領域は運命決定がなされず、したがって多分化能を有した未分化な状態を維持する事により、神経堤やプラコード特有の能力(将来的に骨・神経節・間充織・色素細胞など多種多様な細胞へと分化する能力)を有する事ができ、その細胞内の状態がなければいかなる転写因子が存在しようとも下位のカスケードは動かず、結果として神経堤もプラコードも形成されないという事にある。 この点について異なる方向からの解析を進める為に初期神経胚の神経堤領域に発現する新規遺伝子P2Y4を見いだし、その初期発生における発現パターンを予備実験的に解析した。ヌクレオチド受容体をコードすると考えられるこの遺伝子は、神経胚の神経堤領域に一時的に発現が起こるが、将来的には神経堤に由来する組織での発現は見られず、現時点で推測されているこの遺伝子の働きとして、細胞の未分化性の維持に関わる事がいわれている為に、我々の仮説を支持する重要な分子の一つであるかもしれない。現在、この分子の機能獲得・機能喪失実験を行ない、神経堤とプラコードの形成にどのように関与するのか解析中である。
おわりにここまで脊椎動物の体づくりの仕組みを、イモリとツメガエルを用いた解析の進捗状況として簡単に紹介した。今後は、イモリにおける遺伝子発現の解析や既知の遺伝子の働きを調べ、またツメガエルに実験発生学的方法論を駆使することで、イモリとツメガエルの本質的な相違点と相同点を見いだして行き、その中に神経堤やプラコードの形成機構に関する成果などを当てはめることにより、ゲノムが包含する「脊椎動物の形態」を進化的な視点も含めて考察して行きたい。
参考文献1) Barnstable CJ. (2009). Mitochondria and the regulation of free radical damage in the eye. J Ocul Biol Dis Infor 2:145-148. 2) Bouwmeester H. (2001) The Spemann-Mangold organizer: the control of fate specification and morphogenetic rearrangements during gastrulation in Xenopus. Int. J. Dev. Biol. 45:251-258. 3) Bouwmeester T, et.al. (1996) Cerberus is a head-inducing secreted factor expressed in the anterior endoderm of Spemann’s organizer. Nature 382:595-601. 4 )De Robertis EM, et.al. (2001) Molecular mechanisms of cell-cell signaling by the Spemann-Mangold organizer. Int. J. Dev. Biol. 45:189-197. 5) De Robertis EM. and Kuroda H. (2004) Dorsal-Ventral Patterning and Neural Induction in Xenopus Embryos. Annu Rev Cell Dev Biol. 20:285-308. 6) Glinka A, et.al. (1998) Dickkopf-1 is a member of a new family of secreted proteins and functions in head induction. Nature 391:357-362 7) Joseph JW, et.al. (2004). Free fatty acid-induced beta-cell defects are dependent on uncoupling protein 2 expression. J Biol Chem 279:51049-51056. 8) Koide T, Umesono K, Hashimoto C. (2002) When does the anterior endomesderm meet the anteriormost neuroectoderm during Xenopus gastrulation? Int. J. Dev. Biol. 46:777-783. 9) Lemaire P. and Kodjabachian L. (1996) The vertebrate organizer: structure and molecules. Trends Genet. 12:525-31. !0) Masse K, et.al. (2007). Purine-mediated signalling triggers eye development. Nature 449:1058-1062. 11) Murato Y. and Hashimoto C. (2009) "Xhairy2 functions in Xenopus lens development by regulating p27xic1 expression" Dev. Dyn. 238:2179-2192 12) Nagatomo K. and Hashimoto C. (2007) "Xenopus hairy2 functions in neural crest formation by maintaining cells at mitotic and undifferentiated state" Dev.Dyn. 236:1475-1483 13) Negre-Salvayre A,et.al. (1997). A role for uncoupling protein-2 as a regulator of mitochondrial hydrogen peroxide generation. Faseb J 11:809-815. 14) Sasai Y, et.al. (1994) Xenopus chordin: a novel dorsalizing factor activated by organizer-specific homeobox genes. Cell 79:779-790 15) Sasai Y. (2001). Roles of Sox factors in neural determination: conserved signaling in evolution? Int J Dev Biol 45:321-326. 16) Smith WC. and Harland RM. (1992) Expression cloning of noggin, a new dorsalizing factor localized to the Spemann organizer in Xenopus embryos. (1991) Cell 70:829-840 17) Solnica-Krezel L. (2005) Conserved Patterns of Cell Movements during Vertebrate Gastrulation. Curr Biol. 15:R213-R228. 18) Spemann H. and Mangold H. (1924) Uber Induktion von Embryonalanlagen durch Implantation Artfremder Organisatoren. Roux’ Arch. Entw. Mech. 100: 599-638. 19) Stern CD. (2007) Neural induction: old problem, new findings, yet more questions. Development 132:2007-2021. 20) Wigle JT, Eisenstat DD. (2008). Homeobox genes in vertebrate forebrain development and disease. Clin Genet 73:212-226. 21) Yamada S, et.al. (2006). Uncoupling protein 2 negatively regulates neurite extensions in PC12h cells. Neurosci Lett 410:110-114.
|
 |
 |
 |