年度別活動報告
年度別活動報告書:2005年度
脊椎動物の頭部神経はどのように部域化されるのか
橋本主税(主任研究員)
阿草耕介(研究スタッフ)
皐裕美(研究補助員)
山口真未(大学院生)
永友寛一郎(大学院生)
村戸康人(大学院生)
はじめに
生きものの形やパターンの情報は、非常に大ざっぱには受精卵にも存在するが、実際にはその多くが個体発生の過程で作られる(1)。とはいえ、線虫やホヤなどでは、受精卵が持つ細胞質の情報によってかなりの位置情報が決められており、非対称分裂を行ないながら異なる性質の細胞が組織だって出来上がっていくのであるが、脊椎動物などの胚では、非対称分裂によって細胞の個性を生じさせるには細胞数が多すぎる。そのため脊椎動物の初期胚発生においては、まず確率論的にも見える大まかな領域の形成がおこり、次いで起こる厳密な境界の形成によりパターンが形成されている(図1)。
図1

前者の主役は分泌因子群である。誘導と呼ばれる現象では、特定の組織から因子が分泌され、その濃度勾配に応じて接する組織が分化する。この時、分泌性の因子という必然から、誘導を受ける組織(領域)は非常に大まかであり、誘導をうける組織と受けない組織の境界付近では二種の細胞がごま塩状に入り交じる。分泌因子は、勾配のみならず規則正しい縞模様さえも理論的には形成できるため、自由拡散できる因子によるパターン形成は一つの魅力的な系として注目を浴びている(2)。次に後者、すなわち異なる組織の境界を鮮明にする主役のひとつはDelta-Notchシグナルである。一般的な分泌因子と受容体の関係とは異なり、受容体であるNotchだけでなくリガンドであるDeltaも細胞膜に埋め込まれているため、シグナルが自由拡散してその近隣の複数の細胞に影響を及ぼすことはなく、隣接する細胞の運命のみを明確に限定することができるのである。また、リガンドであるDeltaのNotchとの結合によって自身の細胞へシグナルを入れることも知られているため、物理的に接する細胞両者の性質をきわめて限定的に決定することができるのである(3)。このため、Delta-Notch経路の下流にあることが多いHES関連因子は、無脊椎動物から脊椎動物に至る様々な動物において領域境界に発現することが多く、実際に領域境界の形成に重要な役割を示すことが多くの生きもので既に知られている。
脊椎動物のオーガナイザーと呼ばれる領域は、原腸形成運動を経て神経を誘導し、誘導された神経に頭尾・背腹の軸性を与えるために重要である(4)。当初は明確な領域が存在する訳ではないオーガナイザーも、発生が進むにつれてさらなる領域形成が起こり厳密な領域へと細分化される。オーガナイザーに由来する組織は神経形成とその部域化に重要な働きをする。胚発生過程は、元々のファジーな位置情報からシャープな位置情報を形成する時期であるとも言えるが(5)、オーガナイザーが形成され領域化される時期の胚は、まさに大まかな領域から厳密な領域を形成する過程として捉えることが出来、オーガナイザーに視点を定めた神経のパターン形成研究はその意味においても重要である。
アフリカツメガエルでは、オーガナイザーを誘導するシグナルとしてさまざまなものが知られている。たとえば背側を決めるβカテニンシグナルであり(6)、また、背側に高い活性を持つNodalなどの成長因子群である(7)。これら複数のシグナルによってオーガナイザー特異的遺伝子の発現が誘導される。しかしこれらは基本的に領域を限定する性質ではなく、むしろ体軸の方向性を規定すると考えた方が理に適っている。最も背側辺りの領域にオーガナイザー特異的遺伝子を確率論的に発現させるに過ぎず、その結果としてオーガナイザー活性が現われるが、その場所(の境界)は厳密には全く特定できない。その後のオーガナイザーの形成と領域化にはむしろ転写制御因子と共にDelta-Notchなどの場所を限定するシグナル経路が機能する。ツメガエルのNotch遺伝子はXotchと呼ばれている。Xotch遺伝子の発現はオーガナイザー領域に局在しており、それはあたかもNodalシグナルによって発現が促進されているように見える。また、リガンドであるDeltaはXotchとは相補的に腹側領域で発現が認められ、初期原腸胚ではこれらの細胞は混じることなく、従ってXotchシグナルは境界にある一部の細胞内でしか活性化され得ない。原腸形成運動(収斂伸長運動)が進むにつれて、これらの細胞は背側正中線において混じり合う。この混じり合いはとりもなおさずXotchシグナルのスイッチングを引き起こし、隣接する細胞同士での厳密な境界形成へと通じるものである。これは、形態形成運動が遺伝子発現を制御するという興味深い一例であろう。
我々は、ツメガエルにおいて頭部神経の形成は初期原腸胚で始まっていることを示し(8)、HES関連遺伝子(Xhairy2b)の働きを切り口としてツメガエルの原腸形成時におけるオーガナイザーと神経組織のパターン形成過程を解析している(9)。初期原腸胚のオーガナイザー特異的に発現するXhairy2bは、HES関連蛋白質であること、およびオーガナイザーに局在することを考えあわせると、その後のパターン形成にきわめて重要な働きを持つことが期待される。大まかな領域から厳密な領域が形成されていく流れの中で、Xhairy2bがどのように位置情報を作り上げていくのかを詳細に見ることにより、生き物に普遍的なメカニズムの一端をかいま見る可能性に期待を寄せるのである。さらに、Xhairy2bは神経の領域化にも機能することが分かっており、特に前方部神経領域・予定中脳校脳境界領域・神経提領域などを神経発生のきわめて初期に決定すると考えられる。今年度はこの内、分化と増殖のバランスによってその形成が制御されている前方部神経領域に注目してXhairy2bの働きを解析した(10)。最後に、頭部神経系が詳細に領域化される機構を知るために、将来の視床下部の形成がどのように行なわれるのかについてもXhairy2bの働きを指標として解析した。
オーガナイザーの形成と領域化ならびに神経誘導とその領域化は、まず何もない場所に大まかな領域が形成されて、次いで形態形成運動を伴いながらさらに厳密で詳細な領域を作り上げられる必要があるため、生きものの形づくりの分子機構の解明には最適な生命現象である。これらに、特にXhairy2bとよばれる一つの転写因子を切り口として攻め込むことで、新しい視界が広がることを期待している。
結果と考察
1) Xhairy2b遺伝子は異なる二つの機能を持つ。
Xhairy2bが、様々な形態形成過程でどのように働くのかを知る前に、分子としてのXhairy2bタンパク質が発生現象においてどのように機能しているかを知ることが重要である。Xhairy2bは、初期原腸胚において体幹部体軸の形成を誘導し、頭部の形成を抑制することが既に判明している。これら「誘導と抑制」という両極端の性質を同時に行なう分子機構を明らかにするために、Xhairy2bタンパク質のドメインの働きを解析した。すると、このタンパク質は全く異なる二つの働きを同時に行ないながら体軸のパターン形成を行なうことが分かった。すなわち、転写因子としてではなく、C末端のWRPWモチーフ単独でオーガナイザー特異的な遺伝子群の発現を誘導することができ、結果としてその領域を背側として確立させることが示されたのである。この活性とは別に、もちろん本来の転写抑制因子としての働きも、特定の遺伝子発現を抑制するのに重要である(図2)。
図2
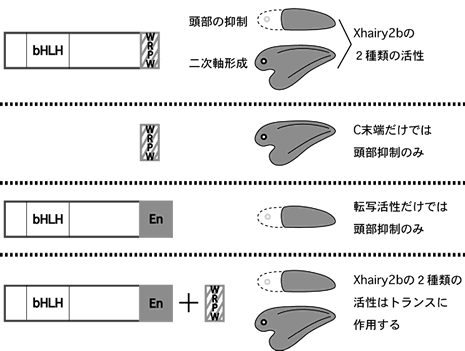
すなわち、トランスに機能しうる二種類の活性を単一分子内(シス)に持っているのである。一般には、ある転写因子による大きな領域形成の後に、異なる転写因子によってその中の特定の領域での遺伝子発現を抑制しパターンを作る事が知られているが、Xhairy2bの分子内多機能性は単一分子でこの二つの働きを可能としているため、進化を通してHES関連タンパク質が領域形成に機能してきたことの意味はここにもあるのではないかと考えている(11)。
2)Xhairy2b遺伝子は、前脳領域のパターン形成に重要である。
一般的に、増殖と分化の関係は互いに表裏の関係であると考えられている。すなわち、増殖中の細胞は分化の方向には向かわず、逆に分化の方向に向かっている細胞は増殖しない。脊椎動物の前方部神経板は、後方部と比べて発生のより後期まで細胞の増殖が維持され神経分化が抑制される事が知られている。神経前方部での増殖を支える転写因子としてはBF1が知られているが、実は、BF1の発現よりも早い時期に神経分化抑制をする働きがあることが分かっている。種々の動物においてHESタンパク質は神経分化を抑制する事が知られており、Xhairy2bは、神経発生のきわめて早い時期に予定神経前方部に発現していることが知られているので、ツメガエルの神経形成、とくに前方部の分化抑制に重要な働きがあると予想される。これまでにもHESタンパク質と神経分化に関する研究は行なわれている。我々は、Xhairy2bを増殖制御という視点から解析した。Xhairy2bの機能阻害実験により、細胞増殖の抑制に働くP27の発現が上昇し、後期における分裂細胞数の減少が見られた。さらに、Xhairy2b機能阻害胚では神経前方部で発現する遺伝子の発現が抑制されていた。これらの事実は、Xhairy2bが前方部神経への分化を抑える一方で、P27の発現をも抑制することにより、増殖と分化の両側面を制御している可能性を示している。
3) Xhairy2b遺伝子は、ツメガエルの形態形成過程で重要な働きをもつ。
初期原腸胚期にNodalシグナルによって誘導されたXhairy2bは、発現した細胞の性質を維持・促進する一方で、他の性質にはならないよう隣接する組織に特異的な遺伝子の発現を抑制することが明らかとなっている(12)。これはつまり、中間的なNodal活性の領域にあってどちらの性質にもなり得るような細胞も、Xhairy2bを一度発現した後は、それぞれ他方の性質へと運命転換することなく、自己の性質を保ちながら混在できることを示している。境界領域での細胞の性質が一定すれば、同じ性質のもの同士が集合する機構が存在することによって、領域間の明瞭な境界が理論的には形成できる。
また、Xhairy2bはXotchの発現を誘導し、同時にdeltaの発現を抑制することが明らかとなった。これによりXotch/Deltaの発現領域が相補的となり、その後の形態形成運動による細胞の混じり合いによって初めて背側正中領域にNotchシグナルが活性化される環境を作り出すことが示唆される。Xhairy2bはNotchシグナルによっても発現が誘導されることから、Delta/Xotchが接する細胞ではXhairy2bの発現が維持され、Xhairy2bの発現が維持されている細胞ではXotchの発現も維持されるという、細胞の位置情報に依存する正のフィードバック制御機構が存在することが示された。ここから、Deltaを発現する細胞に触れていない細胞ではXotchシグナルが入らず、したがってXhairy2bの発現も維持できなくなり、結果としてXotchの発現も低下し、異なる性質の細胞へと分化することが予想される。こうしてDelta/Notch境界の両側の組織が互いに異なる性質を持つ機構が成立するのだろう。Notchシグナルが領域の境界形成に働くことはよく知られており、Xhairy2bはこのような面からも領域境界の明瞭化に関与している可能性がある。
たとえ複数の濃度勾配の重なりを考えたとしても、自由に拡散しうる分泌因子である以上、どうしても影響を与える領域の境界は曖昧にならざるを得ず、したがって微細で厳密な領域は形成しにくい。これが、転写制御の細胞自律的カスケード(13)で神経のパターン形成を語ろうと考えた一つの理由である。今回、非常に小さな領域である予定視床下部領域の形成にXhairy2bが必須な働きをすることが明らかとなった。視床下部の形成には、脊索前板からのSHHやBMPなど分泌因子が必須であることは以前から知られていたが、これら分泌因子によって視床下部ほどの詳細な領域を形成できる機構が説明できなかった。Xhairy2bは、予定視床下部組織を含む底板全体とともに脊索前板にも発現が認められ、機能阻害実験によってその両方の組織でXhairy2bを発現していることが視床下部の形成には必須であることが示された。さらに、これら二つの領域が物理的に接することが視床下部の誘導には重要であることも示された。 これらの事実により、誘導シグナルを受けて視床下部になりうる応答能を持った組織(底板)と誘導能を持つ組織(脊索前板)をともに規定し、それらが接することにより、互いの情報は大まかであっても結果として微細な組織を厳密に誘導することが可能となっているという、一つの領域化の仕組みが示唆された。また、発生の途中までは離れて存在する前方部脊索前板と底板が、形態形成運動によって重なったときに視床下部のマーカーであるnkx2.4の発現領域が決定されたので、正しい形態形成運動(組織の移動)によって、新たな領域が作り出される機構が示された(図3)。発生の後期には、プラコードの概念など、ある誘導能と応答能をもった領域が接することで特定の組織が誘導されることが知られているが、同じような機構が神経発生の初期にも働いており、微細な領域を作りだしていることが考えられる。
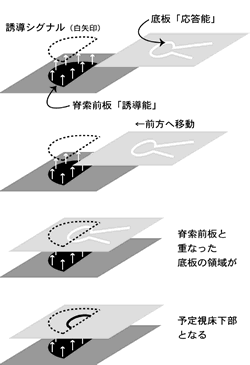
このように、原腸形成期におけるXhairy2bの働きの解明を通して、発生の様々な局面で機能しているであろう領域境界の明瞭化や微細な領域決定の機構が示唆された。
おわりに
脊椎動物のように、パターン形成の初期から数万の細胞を抱える胚発生においては、遊離の分泌因子による「おおまかな」領域形成と、それに伴う厳密なパターンの形成をつなげる機構はまだまだ分かっていないが(14)、今回の結果によりXhairy2bを介した制御機構が重要な働きをすることが示された。しかし、発生現象はこれほど単純ではなく、細胞の増殖分化や形態形成運動、あるいは細胞同士の混じり合いなどを時系列的に整理し直し、そこに様々な分子の働きを並べ直してみなければ、新しい分子機構は見えてこない。これは機械論で論じられるものではなく、特に初期の大まかなパターン形成過程は確率論的であり、たとえばTuring waveなど何らかの波動方程式に則ったパターン形成制御機構の存在も無視できない。最終的に働くのは遺伝子であり分子であるにしても、機械論によって生きもののしなやかさ(いい加減さ)は説明できない。生きものが生きものとして成立する意味とはどこにあるのであろうか?ツメガエルの初期形態形成を見ていくことにより新しい知見を見いだせる可能性に期待したい。
参考文献
1) 近藤滋 「コンピュータを使って発生を考える」(1996) 細胞工学 15(6): 817-824
2) Shoji H, Iwasa Y, Kondo S. (2003) Stripes, spots, or reversed spots in two-dimensional Turing systems. J Theor Biol. 224(3): 339-50.
3) atsube K, Sakamoto K., (2005) “Notch in vertebrates--molecular aspects of the signal.” Int J Dev Biol. 49(2-3): 369-74.
4) Spemann, H. and Mangold, H. (1924) Wilhelm Roux's Arch. 100: 599-638
5) Holloway, D.M., Reinitz, J., Spirov, A. and Vanario-Alonso, C.E. (2002) Sharp borders from fuzzy gradients. Trends Genet. 18: 385-387
6) 橋本主税「オーガナイザー形成の分子機構」(1998) 蛋白質核酸酵素 43(10): 1336-1346
7) De Robertis EM and Kuroda H., (2004) “Dorsal-ventral patterning and neural induction in Xenopus embryos.” Annu Rev Cell Dev Biol. 20: 285-308.
8) oide, T., Umesono, K and Hashimoto, C (2002) When does the endomesoderm meet the anterior-most neuroectoderm during Xenopus gastrulation? Int. J. Dev. Biol. 46: 777-783
9) Tsuji, S., Cho, K.W.Y. and Hashimoto, C. (2003) Expression pattern of a basic helix-loop-helix transcription factor Xhairy2b during Xenopus laevis development. Dev Genes Evol.
213: 407-411
10) Bally-Cuif L, Hammerschmidt M., (2003) “Induction and patterning of neuronal development, and its connection to cell cycle control.” Curr Opin Neurobiol. 13(1): 16-25.
11 )Murato, Y., Yamaguti, M., Katamura, M. Cho, K.W.Y and Hashimoto, C. (2006) "Two modes of action by which Xenopus Hairy2b establishes tissue demarcation in Spemann's
organizer." Int. J. Dev. Biol. in press
12) Yamaguti, M., Cho, K. W. Y. and Hashimoto, C. (2005) "Xenopus hairy2b specifies anterior prechordal mesoderm identity within Spemann's organizer" Dev.Dyn. 234: 102-113
13) Tsuji, S. and Hashimoto, C. (2005) Choice of either b-catenin or Groucho/TLE as a co-factor for Xtcf-3 determines dorsal-ventral cell fate of diencephalon during Xenopus
development. Dev Genes Evol.215: 275-284
14) Ko, M.S.H., Nakauchi, H. and Takahashi, N. (1990) The dose dependence of glucocorticoid-inducible gene expression results from changes in the number of transcriptionally active
templates. EMBO J. 9: 2835-2842
