年度別活動報告
年度別活動報告書:2007年度
脊椎動物の頭部神経はどのように部域化されるのか
橋本主税(主任研究員) 阿草耕介(研究スタッフ)
皐裕美(研究補助員) 永友寛一郎(大阪大学大学院生)
村戸康人(大阪大学大学院生) 川辺実季(大阪大学大学院生)
はじめに
生きものの形づくりにゲノムの情報がどのように関わるのか?私たちは、アフリカツメガエル(以下ツメガエル)の頭部神経系の「かたち」がどのように成立するのかについて解析を進めながら、ゲノムとかたちの関係について考察している。
脊椎動物の形態形成は、初期原腸胚におけるオーガナイザー形成に端を発する。オーガナイザーは頭尾軸・背腹軸の形成を促し背側外胚葉に神経を誘導する(1)。ツメガエルでは、オーガナイザーが形成されると同時に神経誘導およびその大まかな領域化が行なわれると考えられており、大まかに規定された中枢神経領域は、その後の細胞自律的・非自律的な仕組みによりさらに細かな領域へと分化し、視床下部や眼などの微細なパターンを作り上げている。したがって、神経領域のパターン形成には、神経板のパターンを決める一義的な機構と、神経板内部での隣接する領域が二次元方向から相互に作用し合う機構があり、さらに脊索や脊索前板からの三次元的作用などがあり、時間的・空間的にそれらを区別して考慮する必要がある。発生現象を称して「新しい物差しを作って行く過程」であるとチューリングが表現したように、問題の本質は、どのように新しい物差しを作って行くのか、新しい位置の情報をどのように与えるのかに限定できる。この観点に立てば、細胞内で起こる1つ1つの転写制御機構はあくまでも結果であって、遺伝子発現制御によってパターンができるとは考えられない。
我々は特定遺伝子の発現パターンを指標にして、その遺伝子の異所発現や機能阻害によってパターンに生じる変化を解析している。特にXhairy2遺伝子に着目して解析を続けており、現在までに、脊索前板が部域化される仕組みや神経堤領域が形成される仕組みについて成果を上げている。今回は、間脳腹側に位置する微細な領域である視床下部がどのような仕組みでどの時期に規定されるかについて更なる解析を行なった。また、感覚器プラコード形成機構にも脊索前板や神経堤と同様の制御機構が存在する可能性を見いだした。加えて、ミトコンドリア特異的なタンパク質が神経の領域化に重要な機能を有することが分かったことは興味深い。最近の知見から、特にATP/ADPが神経領域のパターン化に重要であることが示唆されており、我々が解析しているタンパク質の働きもATP合成経路に深く関与することから、細胞内環境と細胞運命の決定の間に新しい関連を見いだしているのかもしれない。また、発生における組織の正確な運動は、その後の正確な遺伝子発現に重要であることから、ツメガエルの原腸形成過程や神経形成過程を正確に理解する必要があるにも関わらず、ツメガエルの胚発生のほとんどは不可視であるために、正確な座標軸を与えることのできないままに、主観的・経験的な比較を行なっているに過ぎない。その為に、ツメガエルの中胚葉は動物軸方向に向かって陥入するといった誤りが深く受け入れられている(2)。この点を打破するために、3次元ひいては4次元の画像データベースの構築を試みている。これが完成すれば、たとえば個体ごとにバラバラであり、また研究者の主観にゆだねられて来た胚の発生段階を客観的に記載することが可能となり、内外の研究によって獲得された多大なデータを正確に比較検討することが可能となる。
結果と考察
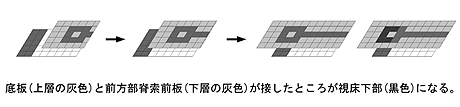
(1) 視床下部形成には前方部脊索前板と前方部底板の接触が必要である
生き物の形を作る過程ではダイナミックな形態形成運動が必要不可欠である。例えば、発生の早い段階では、予定底板は将来眼を作る領域よりも後方に位置しているが、発生が進むにつれ将来眼になる領域を側方に押し分けながらより頭部側へと移動していく。視床下部はこの底板の最先端部より生じる微細な領域である。この予定視床下部の特異化には外胚葉を裏打ちする脊索前板から生じるシグナルが働くと考えられている。しかし、シグナル分子に注目した多くの研究がなされているにも関わらず、脊索前板が実際どのように予定視床下部の特異化に働くかについては幾つかの動物種での断片的な知見があるにすぎない。アフリカツメガエルにおいて、Xhairy2は底板と前方部脊索前板の両方に発現している( 3 )。また、Xhairy2の機能阻害実験から、Xhairy2はどちらの組織形成にも必要であることが示されている(4、5 )。このことからXhairy2は細胞自立的にも、非自立的にも予定視床下部の形成に関与することが期待される。そこで本研究はXhairy2の機能解析を通じて視床下部の形成機構にせまることを目的とした。
移植実験を行い、底板と前方部脊索前板でそれぞれ限定してXhairy2の機能を阻害した結果、底板と前方部脊索前板はそれぞれ独立に視床下部の形成に必要であることが示唆された。次に前方部脊索前板はいつから視床下部の形成に必要か調べるため、外植体を用いた実験を行った結果、予定視床下部の特異化は、後期原腸胚期に起こることが示唆された。この後期原腸胚期は、それまで離れている前方部脊索前板と底板が接する時期である。これらの結果から前方部脊索前板と前方部底板の接触が視床下部の形成に必要であることが示唆された( 図1 )。これは外胚葉と中胚葉の大まかな位置情報を、形態形成運動が重ね合わせることで、微細な領域を正確な場所・時間で形成する一例と考えられる。
図1
(2) 感覚器プラコードはどのように成立するのか?
脊椎動物の中枢神経系は、表皮と同じく外胚葉に由来する。しかし、ひとたび予定神経領域、即ち神経板が決定されたら、神経板は神経管を形成して表皮から分離し、体内へとその所在を変更する。これと対比して、末梢の感覚器官(嗅覚、視覚、聴覚)は、対応する中枢神経に隣接する表皮領域(神経板の外側)から形成される。神経管閉塞後の咽頭胚期になると、中枢神経系からのシグナルにより、感覚器官を形成する表皮が肥厚しプラコード(感覚器官原基)を生じる。以降、各プラコードで分化が進み、刺激受容細胞や腺細胞・ニューロンなどを産生する。ここで、中枢神経系からのシグナルを受ける以前の対応する表皮はなんら運命決定を為されていないと考えられていたが、Jacobsonの古典的実験により、神経管閉塞以前の後期神経胚で対応する表皮領域は各プラコード固有の性質をある程度獲得していることが示唆されていた(6)。また、過去の多くの観察事実によって、将来プラコードを形成する領域を含んだ神経板の周囲は、それ以外の表皮領域よりも若干肥厚していることが明らかになっている(ニワトリを除く)。よって、「プラコードの原基」が、神経胚期に神経板周囲の馬蹄形の領域に配置されており、この領域はプレプラコード領域であると考えられるようになった(7)。その後、six1などプレプラコード全域で発現する遺伝子が単離されたことを契機に、プレプラコードの存在は広く認知されるに至っている。ただし、プレプラコードの生物学的な意義の詳細な解明は、今後の課題である。
視覚の感覚器官である眼は、その構成要素をレンズと網膜に大きく二分することができる。網膜は間脳の一部の突出である眼胞・眼胚を経て形成され、レンズは眼胞と接した表皮でレンズ誘導が起こり、レンズプラコード・レンズ胞を経て形成される。特にレンズの形成については、眼胞から表皮へと渡りレンズプラコードを誘導するシグナルの実体を解明する目的での研究が進んでいる。ところが、これと相反する観察事実として、眼胞不在の条件でレンズ様体(レンズ構成タンパク質であるクリスタリンを発現する細胞の塊)が形成されることから、表皮側の性質を研究する必要性が議論されてきており、レンズプラコード以前の表皮、即ち、予定レンズ外胚葉(presumptive lens ectoderm: PLE)における初期の遺伝子発現に注目が集まり始めた。その結果、pax6やsix3といった本来網膜領域で発現する遺伝子が、PLEで限局した発現を示すことが明らかになった。更に、PLEにおけるpax6やsix3を特異的にノックアウトすると、細胞増殖が低下しレンズプラコードが形成されないことがマウスで示されている。これらの結果は、少なくとも、PLEにおける適切な遺伝子発現がレンズ形成に必要とされることを示している(8)。そのため、どのようにPLEが規定されるのか、PLEはどういった性質を有するものなのかを明らかにすることは、レンズ形成の初期過程を解析する上で意義があることである。
我々がこれまで注目してきたXhairy2遺伝子は、中枢神経系領域を囲むように発現している。Xhairy2の発現が神経堤の形成に必須であることを既に示したが、神経堤を除いた神経板の前方を囲む領域でのXhairy2の機能は不明であった。この領域はプレプラコード領域であるため、この領域でのXhairy2を機能阻害した結果、レンズ(水晶体)の形成不全が起こっていることが明らかになったが、神経網膜にはほぼ異常が見られない。さらにcrystallinとL-mafの発現を確認したところ、顕著な減少が見られた。次に、神経板期から既に発現領域が明確に認識できるpax6とsix3に注目し、Xhairy2機能阻害胚でのPLEの発現を確認した。Pax6とsix3は主に予定網膜領域(前脳)で発現しているが、この領域の発現に変化は見られず、PLE特異的に発現が消失した。Pax6やsix3のPLEの発現には、神経板前方部からのシグナルが必要であると言われているが、その実体は現在のところ未知である。そのため、Xhairy2の機能阻害が受け手と送り手のどちらに影響を与えているのか厳密には決定できないが、少なくとも神経坂内での遺伝子発現には影響が見られず、また、シグナル候補うちのbmp4の発現に影響が見られない。よって、Xhairy2はPLEの形成に対して細胞自律的になんらかの形で関与していることが推測できる。我々は以前にXhairy2の機能阻害により、ニューロン前駆マーカーのXdelta1と細胞周期阻害因子p27の発現が部域特異的に上昇することを示した。これらによってPLEが形成されなくなったと考えられたため、Xdelta1とp27のmRNA過剰発現を行ったところ、Xhairy2機能阻害と同じようにPLEにおけるpax6の発現が消失することを確認できた。次に、Xhairy2機能阻害の影響をXdelta1或はp27の機能阻害で緩和できるか確認した結果、p27モルフォリノはXhairy2機能阻害によるPLEでのpax6の発現消失を緩和できるが、Xdelta1モルフォリノについては目立った効果は見られなかった。この結果は、PLEの形成には、Xhairy2によるp27の発現抑制が必要であることを示す。
本研究の結果は、Xhairy2はPLEにおいてp27を抑制し細胞周期を維持することで、未分化状態を維持しているということである。レンズ形成において最終分化の開始はcrystallinの転写開始にあたり、これが引き起こされるのはレンズプラコード形成以降である。そのため、Xhairy2がPLE形成以前からp27のような分化マーカーの発現を積極的に抑制していることは、レンズ形成で必要とされるステップと矛盾しない。また、我々の結果は神経底とPLEの形成過程について、共通の必要項が存在することをXhairy2の発現と機能を通じて示唆している。神経堤とプラコードは脊椎動物に特有のもので、多分化能を共通に有するが移動能の有無などに差異を示す(9)。そのため、進化におけるこの二つの組織の由来が同じものなのか異なるものなのか、現在も議論が続いている。我々の研究結果は、この二つの組織が進化的に同一の組織から生じたものであることを暗示しているのかもしれない。
(3) 神経領域の発生におけるミトコンドリア内膜タンパク質UCP2の役割
終脳・間脳・中脳・後脳からなる脊椎動物の脳の形成は、ツメガエルにおいては初期原腸胚期に神経誘導と同時に起こると考えられている。この時期には神経板すら形成されていないため、各領域についてはマーカー遺伝子の発現パターンを解析することとなり、結果として転写制御のカスケードの研究が大きく進んでいる。しかし近年、細胞増殖など細胞の状態も領域化には重要であることが示されている。
ミトコンドリア内膜に局在するタンパク質であるUCP2は、エネルギー代謝に関与することが知られている他に、細胞内ATP濃度の調節や活性酸素種産生の抑制など細胞内環境に大きな影響を与えることが知られている。また、ほ乳類においてUCP2の発現が特定の神経領域で見られることなどから、近年では脳の機能との関わりが注目されているが、神経発生との関係については調べられてこなかった。そこで我々は、ツメガエルUCP2の神経発生過程における発現パターンを解析し、またその機能阻害・異所発現実験を行なうことによってUCP2が神経の領域形成にどのように関わるかについて解析している。
UCP2は胞胚で動物極側の外胚葉に広く発現しているが、原腸形成が始まる初期原腸胚では、背側外胚葉に限局する。その後初期神経胚になると周囲の発現が消失し、左右の予定後脳領域前方の一部に限局する。また、このころから将来眼を形成する領域での発現も見られる。初期尾芽胚になると、後脳のより前方および後方部分や、鰓弓の周辺・体節でも発現が見られるようになる。オタマジャクシの脳では後脳の分節構造の他、終脳・間脳でも発現が見られた。これらの発現パターンから、UCP2が脳の発生に何らかの関わりがあると考え、次にアンチセンスモルフォリノオリゴを用いたUCP2の機能阻害およびmRNAの顕微注入による過剰発現実験を行ない、領域化に関わるマーカー遺伝子の発現の変化を観察した。UCP2を機能阻害すると、初期神経胚においてKrox20(後脳)・En2(中脳後脳境界)・BF1(終脳)といった広い範囲でマーカー遺伝子の発現の減少が見られた。また過剰発現を行なうと、初期神経胚でPax6やSox2の発現領域が広がった。これらのことから、UCP2が初期の神経領域の発生に何らかの関わりがあることが示唆される。今後、具体的にどのような機構でUCP2が神経領域の発生に関わるのかを調べる。
(4) ツメガエル胚発生過程の3D画像構築
ツメガエル胚の胚発生過程をより理解しやすくするために、私たちは胚内部構造の時系列に沿った胚発生過程のシミュレーションを行なうことを目的としている。
まず発生過程のシミュレーションを考えるにあたって、コンピュータ内にツメガエル胚の3次元立体像を再現する必要がある。従来、生体の3次元立体像を再現するためには、CTスキャナやMRI、共焦点レーザー顕微鏡と言った機器を用いて試料の断層像を撮像し、一連の2次元画像群から3次元立体像を再現する方法がある。しかしながら、CTスキャナやMRIは撮像する試料の大きさに制限があり、ツメガエル胚のような直径約1.0mm程度の試料では小さ過ぎるため撮像ができず、また、共焦点レーザー顕微鏡ではマイクロオーダーの試料を対象としており、かつ試料の透明性が求められる。このような問題点から、従来の方法を取らず、私たちは3次元内部構造顕微鏡(10)を用いることとした。これは理化学研究所(11)や食品総合研究所(12)で開発・利用されている装置で、試料をパラフィンや凍結包埋し、ミクロトームを用いて表面を切削しながらその断面を固定した撮影装置で直接撮影することで、一連の断層像を取得する方法である。この方法の利点は、対応するレンズとステージさえあれば試料の大きさに制限が無いこと、定点で撮影するので後に画像群の位置合わせが不要であること、カラー情報を取得できること(今回の撮影方法では、試料の特性からグレースケールのみとなる)が挙げられる。
私たちは、この装置を参考にして私たちの目的に適った3次元内部構造顕微鏡を開発した。まず、対象の大きさから詳細な断面像を取得するために包埋材として樹脂を選択した。さらに、ツメガエル胚は内部に中空があるため、通常のレンズでは断面だけではなく、被写界震度の特性から奥情報も同時に撮影してしまうため、ガラスや鏡などの表面構造を観察するためのレンズ装置である同軸落射照明装置を用いた(そのため、試料のカラー情報は失われることとなった)。
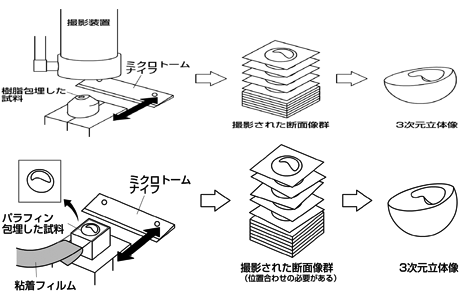
新たな方法として粘着フィルムによるパラフィン切片回収に取り組んでいる(川本法)。これは、従来のパラフィン切片回収では、全試料断面の形状を保ったままスライドガラスに転写することは不可能であった。しかしながら、粘着フィルムを予めパラフィンブロックに接着し切削することで、形状を保ったまま切片の回収が可能となり歪みの無い断面像を取得することができる。この方法の利点として、回収された切片に対してin situハイブリダイゼーション染色を行なうことで、試料の形状と共に遺伝子発現領域を含んだ3次元立体像の再現が可能である。

これらの技術を統合した結果、上図のような内部構造を含めたツメガエル胚の3次元立体像をコンピュータ内に再現することができた。この3次元立体像はコンピュータ内で自由に移動・回転・拡大/縮小することが可能であり、また、内部構造をあらゆる面から表示することができる。この3次元立体像から特徴要素を計測し、胚発生過程の時間的推移とその形状との特性を解析することで、外部形態のみから作成された従来のステージ基準ではなく、内部構造を含んだ新しいステージ基準作成を試みている。現在、その解析用のツールを開発中である。
おわりに
本報告では、Xhairy2を指標とした解析から、組織運動と領域形成の関連性に新たな知見を得ることができた。また、プラコード形成をどのように制御するかについての解析から、プラコードが脊索前板や神経堤と分子レベルでも潜在的に共通していることが見いだされ、この三者が持つ共通の性質から、Xhairy2が関与する細胞周期の維持をキーワードにして系統発生的な意味を考察することができるのではないかと期待している。脊椎動物と無性きつい動物を考える上で、hes遺伝子群と細胞周期の知見から共通理解に到達できないかについて考察を試みることは重要であろう。
参考文献
1) Spemann, H. and Mangold, H. (1924) Wilhelm Roux's Arch. 100: 599-638
2) Koide, T., Umesono, K and Hashimoto, C (2002) When does the endomesoderm meet the anterior-most neuroectoderm during Xenopus gastrulation? Int. J. Dev. Biol. 46: 777-783
3) Tsuji S, Cho KW, Hashimoto C. 2003. Expression pattern of a basic helix-loop-helix transcription factor Xhairy2b during Xenopus laevis development. Dev Genes Evol 213: 407-411.
4) Yamaguti M, Cho KW, Hashimoto C. 2005. Xenopus hairy2b specifies anterior prechordal mesoderm identity within Spemann's organizer. Dev Dyn 234:102-113.
5) Murato Y, Nagatomo K, Yamaguti M, Hashimoto C. 2007. Two alloalleles of Xenopus laevis hairy2 gene-evolution of duplicated gene function from a developmental perspective.
Dev Genes Evol 217:665-673.
6) Jacobson, A. G. (1963). The determination and positioning of the nose, lens and ear. III. Effects of reversing the antero-posterior axis of epidermis, neural plate and neural fold. J. Exp.
Zool. 154, 293-303
7) Streit, A. (2004). Early development of the carnial sensory nervous system: from a common field to individual placodes. Dev. Biol. 276, 1-15.
8) Ogino, H. and Yasuda, K. (2000). Sequential activation of transcription factors in lens induction. Dev. Growth. Differ. 42, 437-448.
9 Shimeld, S. M. and Holland, P. W. H. (2000). Vertebrate innovations. Proc. Natl. Acad. Sci. USA. 97, 4449-4452.
10) 小林、樋口、青木、工藤(1995) 「三次元内部構造顕微鏡の開発」 精密工学会誌, 第61巻, 第1号, 100-106
11) 横田秀夫(2004)「生体を対象としたディジタイジングのための三次元内部構造顕微鏡の開発」 生体力学シミュレーション研究プロジェクト第一期成果報告会予稿
12 小川、宮下、清水、杉山(2003) 「連続切片の自家蛍光観察によるダイズ種子の3次元内部構造」 日本食品科学工学会誌 Vol.50, No.5, 213-217
