年度別活動報告
年度別活動報告書:2011年度
脊椎動物の頭部神経はどのように部域化されるのか
橋本主税(主任研究員) 西原あきは(奨励研究員)
皐 裕美(研究補助員) 益田真都香(大阪大学大院生)
伊藤賢太(大阪大学大院生)
はじめに
脊椎動物の胚発生を受精から経時的に観察すると、卵の大きさや形、あるいは細胞分裂様式など種によって様々であり、そこに見かけ上の普遍性は見いだせない。しかし、形態的に多様な胚が原腸形成過程を経て神経胚となり咽頭胚を形づくると、種を越えて高度に保存される形をとる。また魚類・両生類・鳥類・哺乳類の個体発生過程において発現する遺伝子のプロファイルを種間で比較したところ、咽頭胚に発現する遺伝子のレパートリーが種を越えてもっとも似通っていることが分かった1)。大きさも形も、さらには卵割様式や遺伝子発現の時期や場所まで種によって大きく異なる初期発生過程だが、原腸形成運動が終わるとほとんどの種で互いに似通った形をとること、原腸形成過程を経て脊椎動物特有の細胞として知られる神経堤が生じることなどから、この原腸形成過程こそが脊椎動物の形づくりにとって最も重要であると我々は考えている。また原腸形成過程に関わる鍵となる遺伝子群は脊椎動物において種を超えて保存されると考えられているが、実際の原腸形成運動とそれに伴う神経や頭部の形成を担う組織の運動には、見かけ上の類似性があまり見られない。
そこで私たちは、脊椎動物のかたち作りを知るという目的のためにアカハライモリ(以下イモリ)とアフリカツメガエル(以下ツメガエル)を実験材料として研究を行なっている。その理由は、系統的に見て脊椎動物の中でもかなり近縁な種であるにもかかわらず、その原腸形成様式が組織運動の方向や遺伝子発現の時期などが互いにかなり異なっていることが明らかとなっている為、両者の比較から見いだされる相違性を排除した結果として残る質的に相同な現象こそが脊椎動物を通じて保存されている重要な現象ではないかと思えるからである。脊椎動物に潜在すると思われる原腸形成過程の普遍性を見いだす目的で、今年度は、ツメガエルにおいて原腸形成・神経形成・神経堤形成に重要であることが知られている種々の遺伝子をイモリから単離し、発現パターンの解析を行なった。
また、脊椎動物を定義するとも言われる神経堤が形成される機構を知ることは、個体発生の過程として興味深いだけでなく系統発生の視点からも重要である。神経堤細胞が特異化される分子機構はツメガエルにおいて詳細に解析が進んでいるものの、転写因子のカスケードを主体とする解析が主であり、それ以外には細胞周期との関連などがわずかに知られているのみである。そこで今年度は、神経堤の成立機序を明らかとする目的で、初期神経胚の神経板境界領域に特異的な発現が認められる、ヌクレオチドレセプターP2Y4およびP2Y11の発現パターンを解析し、アンチセンスモルフォリノによる機能阻害実験などを行ない、これらレセプターが神経堤の形成に極めて重要な働きをすることを明らかにした。
結果と考察
イモリ神経胚特異的遺伝子の単離と発現パターンの解析
私たちは、ツメガエルの原腸形成運動が、前方内中胚葉が動物極頭頂部へさかのぼるイモリのような陥入ではなく、脊索中胚葉の尾部方向への伸長であるというモデルを提唱し2)、核磁気共鳴装置を用いた微速度撮影の解析でも、これが正しいことが支持された3)。この運動の違いは、予定頭部神経領域のオーガナイザーによる裏打ちが、ツメガエルでは原腸形成運動前からであるのに対し、イモリでは原腸形成運動の最後に行われることを意味し、頭部神経形成機構が両種間で大きく異なる可能性があることを意味する。現に、分子生物学的な解析が進んでいるツメガエルの頭部形成機構をイモリにあてはめようとすると、多くの矛盾が出てくる。そこで、イモリとツメガエルの頭部形成機構を詳細に解析・比較し、相同性と相違性を明らかにすることで、脊椎動物一般に共通した部分が見えてくるのではないかと考えた。この目的のために、今年度は遺伝子情報が少なく研究が遅れていたイモリの頭部形成過程における分子発生学的知見を蓄積することを重点課題とし、頭部形成に重要な遺伝子の発現パターン解析を進めた。
まず、昨年度と今年度の次世代高速シーケンス技術によるイモリ原腸胚と神経胚RNAの網羅的な配列解析により、数万の遺伝子情報を得た。そこからオーガナイザーや神経のマーカー遺伝子を中心に、約40のイモリの遺伝子を単離し、in situ hybridization法によりそれぞれがどの時期にどの場所で発現するのかを調べた。
イモリとツメガエルの形態形成遺伝子発現パターンの比較解析
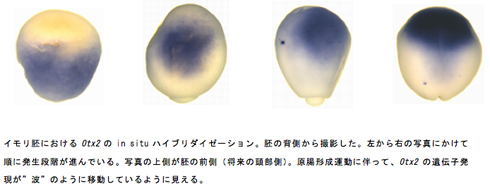
これまで、両者の原腸形成過程は同じ機構であると信じられ、ツメガエルで得られた分子生物学的な知見をイモリのモデルに則して議論されてきたのであるから、両者の原腸形成運動が全く異質なものであることが分かった今、もう一度最初から「原腸形成」というものを理解していく必要が生じている。ツメガエルとは異なり、イモリの遺伝子はその配列が未同定のものが多く、原腸形成運動に関わる種々の組織マーカー遺伝子の発現で両者の原腸形成を比較するためには、イモリの初期胚で発現するRNAから、解析に必要な遺伝子を単離する必要があった。そこで、イモリ神経胚・原腸胚特異的に発現するRNAを濃縮し、このRNAの配列を次世代高速シーケンス技術により網羅的に解析した。これにより得られた数万個の遺伝子から解析に必要な遺伝子を選別し、in situ ハイブリダイゼーションを目的としたRNAプローブを合成した。そのプローブをもとに様々な遺伝子の発現パターンを解析し、ツメガエルとの比較を行っている。まず、神経誘導とその部域化に注目して解析を行なった。ツメガエルにおいて中胚葉は、すでに部域化されたものとして初期原腸胚で形成され、それらは原腸形成運動に伴って頭尾軸に沿って並び替えられるに過ぎず、同様に神経も初期原腸胚に誘導され、その大まかなパターンも決まっている。しかし、イモリでは原腸形成運動を行ないながら中胚葉を形成し、原腸形成運動に伴ってその部域化が起こり、原腸形成運動の完了を待って、神経の頭尾軸のパターンが中軸中胚葉の頭尾軸のパターンに依存して決まると考えられる。しかし、ツメガエルの初期原腸胚で発現が始まる神経領域特異的マーカーであるOtx26)のイモリでの発現を実際に観察すると、ツメガエル同様、初期原腸胚のシュペーマンオーガナイザーの領域に現れた。中期原腸胚には、陥入した中胚葉領域とそれを覆う外胚葉領域に発現が見られた。そして、後期原腸胚には、中胚葉領域の発現が消え、予定神経領域に発現が始まり、その発現が初期神経胚にかけてしだいに前方へ移動しているように見られた。これよりイモリでは、原腸形成の完了の後に神経誘導が起こるのではなく、原腸形成運動に伴って、遺伝子発現が”波”のように移動しながら神経誘導をおこなっている可能性が考えられる。また、神経・表皮境界領域に形成される神経堤の特異的マーカー遺伝子のひとつであるsnail7)は、ツメガエルでは最も初期に発現する神経堤マーカーで、初期原腸胚(St.11以前)において、予定神経領域と予定表皮領域の境界領域に発現を始める。これに対し、イモリ初期原腸胚では、原口背唇領域に馬蹄形に発現したが、これが直接的に神経堤に関わっている発現とは考えにくい。その後、予定神経堤領域に発現が見られるのは初期神経胚の神経褶が隆起を開始する直前の時期であった。他の神経堤特異的マーカーのfoxD38)やtwist9)は、ツメガエルでは初期神経胚(foxD3:St.13 , twist:St.14)で、予定神経堤領域に発現が始まる。これに対し、イモリのfoxD3は初期神経胚では神経板領域に全体的に発現し、神経褶が隆起し始める時期に予定神経堤に発現が始まった。twistは初期から後期神経胚を通して中軸中胚葉と側板中胚葉に発現していたが、神経堤領域に発現を始めるのはかなり遅く、神経管が閉じきった後の初期尾芽胚からであった。このように、種々の神経堤特異的マーカーの発現パターンがイモリとツメガエルで、大きく異なっており、今後さらにこの発現パターンの推移を詳細に比較することにより、中枢神経の出来上がり方と原腸形成運動との関係性が明らかになり、他の脊椎動物種との比較につなげていくことができると期待している。
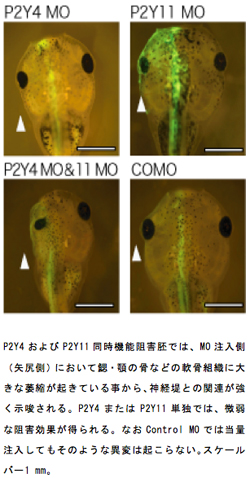
ツメガエルの神経堤細胞形成にヌクレオチド受容体P2Y4とP2Y11の働きが重要である
脊椎動物を規定するともいえる神経堤とプラコードの形成には、転写因子のカスケードのみではなく、細胞周期の制御が必要であると以前の研究10),11)で判明した。この点について異なる視点からの解析を進める為に、私達はヌクレオチド受容体の一種であるP2Y4およびP2Y11 に着目している12)。このヌクレオチド受容体の働きが、あまり発生と関連して研究がなされていない。また他の細胞からの情報を受け取る受容体という特性は、細胞内の転写因子間の関わりだけでなく、細胞間の関わりをも解き明かせるのではないかと期待できる。私達はP2Y4が神経胚期において表皮—神経境界に、P2Y11は表皮-神経境界および神経板内部に発現が限局されていたことから、この発現領域から神経堤およびプラコードとの関連を予想している。しかし、別個にP2Y受容体は細胞周期に関わるという報告13)もあり、神経堤の形成に関連して注目すべき点であろう。
あらかじめ有効性を確認したアンチセンスモルフォリノオリゴ(MO)による、P2Y4またはP2Y11それぞれの単独機能阻害胚では、予想通り神経堤およびプラコード由来の構造物である軟骨組織・眼に微弱な阻害効果が得られた。しかし阻害胚は神経堤マーカーのtwistの発現を阻害したが、同じ神経堤やプラコードの遺伝子であっても他のマーカーには顕著な異変が無かった。ちなみにP2Y4には、開始コドン上流に異なる配列を持つ4種類のスプライシングバリアントを持つことが分かった。これらすべての配列に至適と思われるMOを作成しそれぞれ、あるいはすべてを同時に胚へと導入することで機能阻害実験を行なったが、すべてのRNAに共通の配列に対するMO単独を用いた場合と比べてその効果は変わらなかった。次に、P2Y4とP2Y11を同時に阻害してみたところ、頭部構造の大きな萎縮を観察した。この同時機能阻害胚は、初期胚において神経堤の誘導に必要なhairy2b,snailの発現には影響を与えず、特異化された神経堤で発現するfoxD3,slug,twistの発現を阻害していた。この事からP2Y4およびP2Y11は神経堤の誘導には必要ではないが、snailやXhairy2による特異化に必要であると推測される。しかし意外な事に、プラコードマーカーdlx5の発現に対しては神経胚後期までは影響を与えず、中期尾芽胚期になって発現を阻害した。同時機能阻害胚では眼の形態異常も引き起こす。オタマジャクシ幼生の切片を作成・観察したところ、レンズおよび網膜は共に形成されていることが分かった。加えて、脊椎動物において網膜は脳から出来るため、脳の遺伝子発現へ影響が無いかを調べてみたが、神経胚期に後脳のマーカーkrox20, 中脳後脳境界マーカーen2, 網膜マーカーsix6・pax6の発現パターンに変化は見られなかった事から、網膜および脳の分化への直接の影響は考えにくい。従ってP2Y4−P2Y11機能阻害のプラコードや眼における影響は、分化の後に起こる二次的なものが原因なのではないかと考えられる。つまりP2Y4とP2Y11同時機能阻害胚における頭部異変の本質は、神経堤由来の構造物の形成不全であり、幼生期はじめの軟骨組織による左右への頭部拡充が出来なかったため、結果として眼の萎縮およびプラコードマーカーの発現を阻害したのではないだろう。またP2Y4-P2Y11同時機能阻害胚の一部では、アポトーシスを起こしている事が観察出来た。加えてP2Y4とP2Y11のそれぞれ単独の機能阻害ではあるが、 一定時間における細胞分裂には大きな影響が見られなかった。さらにhairyの機能阻害を行なうと、細胞周期阻害因子の異所的発現が起きるが、 P2Y4-P2Y11機能阻害胚では起きなかった。
よってP2Y4およびP2Y11同時機能阻害胚ではアポトーシスが起こるが、 P2Y4およびP2Y11が細胞周期に関わる可能性は薄い。以上のように、細胞周期およびプラコードには関連が無いという結果は意外であったが、ヌクレオチド受容体P2Y4およびP2Y11は、神経堤の形成に必要である事が証明出来た。単独機能阻害では神経堤形成に微弱な影響しか与えられなかった理由は、P2Y4とP2Y11の神経堤維持に対する機能が相補的なものである可能性と、 神経堤は一つの因子の不在でも大きな異変をきたす可能性の二つが考えられる。今後は、その解明の為に、今回達成出来なかったもののひとつであるレスキュー実験と組み合わせて、P2Y4またはP2Y11の阻害胚をP2Y11mRNAまたはP2Y4mRNAのそれぞれでレスキューが可能かどうか検証したい。
おわりに
イモリの遺伝子を単離し、その発現パターンを発生の文脈で解析することにより、イモリとツメガエルの原腸形成・神経形成・神経堤形成の相違点が明らかとなってきた。これまでも我々はイモリとツメガエルはかなり違うと主張してきたが、遺伝子発現パターンの相違を見ると、我々の予想以上におおきく異なっている様子が明らかとなってきた。今後は、イモリにおける遺伝子の機能阻害実験法の確立と異所的遺伝子発現の実験を組み合わせることで、さらにツメガエルとの相違点を明らかにしていきたい。特に、中軸中胚葉や中枢神経系のパターンが形成される時期の違いとその分子機構を解明することは重要であろう。また、ツメガエルにおける神経堤形成に、snailから始まる転写因子カスケードとXhairy2による細胞周期の制御に加えて、P2Yによる第三の分子機構の存在が見えてきた。P2YはGタンパク共役型であり、細胞内のCaやcAMPの濃度を制御していることが知られている為に、神経堤とこれら因子との関わりを解析することは興味深い。
引用文献
- 1)Irie N, Kuratani S. (2011) Comparative transcriptome analysis reveals vertebrate phylotypic period during organogenesis. Nat Commun.59:893-903.
- 2)Koide T, Umesono K, Hashimoto C. (2002) When does the anterior endomesderm meet the anterior-most neuroectoderm during Xenopus gastrulation? Int J Dev Biol. 46:777-783.
- 3)Papan C, Boulat B, Velan SS, Frazer SE and Jacobs RE (2007) Formation of the dorsal marginal zone in Xenopus laevis analyzed by time-lapse microscopic magnetic
- resonance imaging DevBiol 305:161-171.
- 4)Kelly GM, Erezyilmaz DF, Moon RT (1995) Induction of a secondary embryonic axis in zebrafish occurs following the overexpression of beta-catenin. Mech Dev. 53:261-73.
- 5)Doi JY, Niigaki H, Sone K, Takabatake T, Takeshima K, Yasui K, Tosuji H, Tsukahara J, Sakai M (2000) Distribution of dorsal-forming activity in precleavage embryos of the
- Japanese newt, Cynops pyrrhogaster: effects of deletion of vegetal cytoplasm, UV irradiation, and lithium treatment. Dev Biol. 223:154-68.
- 6)Blitz IR and Cho KWY (1995) Anterior neurectoderm is progressively induced during gastrulation: the role of the Xenopus homeobox gene orthodenticle. Development.
- 121:993-1004.
- 7)Essex LJ et al. (1993) Expression of Xenopus snail in mesoderm and prospective neural fold ectoderm. Dev Dyn. 198:108-22.
- 8)Pohl BS, Knöchel W. (2001) Overexpression of the transcriptional repressor FoxD3 prevents neural crest formation in Xenopus embryos. Mech Dev. 103:93-106.
- 9)Hopwood ND et al. (1989) A Xenopus mRNA related to Drosophila twist is expressed in response to induction in the mesoderm and the neural crest. Cell.
- 10)Nagatomo K, Hashimoto C(2007)Xenopus hairy2 functions in neural crest formation by maintaining cells in a mitotic and undifferentiated state. Dev Dyn 236:
- 1475-1483
- 11)Murato Y and Hashimoto C(2009)Xhairy2 Functions in Xenopus Lens Development by Regulating p27xic1 Expression. Dev Dyn 238:2179–2192
- 12)Eduardo R. Lazarowski, Boucher RC, and Harden TK(2003)Mechanisms of Release of Nucleotides and Integration of Their Action as P2X- and P2Y-Receptor Activating
- Molecules. Mol Pharmacol 64:785–795
- 13)Aina V. H. Greig, Linge C and Burnstock G(2008)Purinergic receptors are part of a signalling system for proliferation and differentiation in distinct cell lineages in human anagen hair follicles. Purinergic Signalling 4:331–338
