年度別活動報告
年度別活動報告書:2013年度
両生類の原腸形成運動と頭部構造の形成
橋本 主税(主任研究員) 西原 あきは(奨励研究員)
伊藤 賢太(大阪大学大学院生)西田 遥(大阪大学大学院生)
南野 怜香(大阪大学大学院生)楊 貴成(大阪大学大学院生)
守 翔子(研究補助員)
はじめに
両生類の形態形成過程の中で最も重要な現象のひとつが原腸形成である。原腸形成過程では、初期原腸胚の原口背唇部に位置するオーガナイザーと呼ばれる機能領域が、原口を通って内部領域と陥入し、胞胚腔の屋根を裏打ちするかたちで頭部方向へとさかのぼることにより,動物極周辺に頭部が決まるとされている。したがって、最初に陥入が始まる原口は結果的に尾部となり、両生類の頭尾軸は尾部から頭部へと形づくられると考えられてきた。また、オーガナイザー領域には明確な位置情報が存在し、初期原腸胚の原口背唇部は頭部の、続いて陥入する領域が体幹部の、最後に陥入する領域が尾部の形態形成を誘導する能力があると信じられていることから、それぞれ頭部・体幹部・尾部オーガナイザーと呼ばれる(図1)。しかしながら、アフリカツメガエルを用いた我々の研究から、そもそもオーガナイザーのさかのぼり運動はほとんど見られないこと、予定頭部領域は動物極周辺ではなく赤道部分にあることなどが明らかとなり、原腸形成運動自体を見直す必要性が生じてきた。
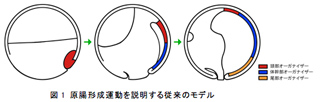
両生類の原腸形成過程をあらためて見直すために、我々は今年度、大きく二種類のテーマを掲げて解析を進めた。第一に、多岐にわたる両生類種を用いて、アフリカツメガエルで得られた結果が他の両生類にも適用できるのかについて解析を進めたところ、解析したすべての両生類種において中軸中胚葉のさかのぼりは起こらないことが明らかとなった。第二に、ツメガエルでの尾部形成機構を解析したところ、後期胞胚・初期原腸胚の胞胚腔の屋根と床を物理的に接触させることで異所的に第二の尾部が生じることが明らかとなった。種々の解析からこの第二の尾部の形成過程は第一の(本来の)尾部の形成と同様の機構によると考えられ、尾部オーガナイザーと呼ばれる機能領域の存在そのものがあらためて再考察されるべきであろうことを示した。脊椎動物を脊椎動物たらしめている構造として頭部構造が上げられる。我々は、神経堤・プラコード・頭部神経など、脊椎動物の頭部を構築する領域に初期胚を通じて特異的に発現する遺伝子としてP2Y受容体の機能を解析したところ、モルフォリノオリゴによる機能阻害では頭部構造の形成に重大な影響を与え、TALENヌクレオチドによる遺伝子破壊ではほとんどの場合に初期胚致死の表現型が得られた。しかし、ごくまれに尾芽胚期まで発生できた胚では頭部構造の著しい矮小化がみられ、これら受容体の機能が脊椎動物の頭部形成に重要なはたらきを有することが示唆された。
結果と考察
オーガナイザーと予定頭部神経が接する時期と場所
脊椎動物の形づくりに重要な咽頭胚は原腸形成過程を経て作られる。両生類の原腸形成では、神経を誘導する中軸中胚葉は、原口から動物極に向かって遡り、最後に頭部の場所を決めると考えられている。しかし、アフリカツメガエルでは、頭部の場所が初期に決定し、最初に原口が出来た場所から尾部方向へ軸を形成していくことを我々は明らかにした1)。アフリカツメガエルは両生類のモデル動物として世界中で広く研究されているが、日本の野外で見られるカエルとは系統的に大きく離れている2)。アフリカツメガエルで見られた原腸形成過程がその種独特のものなのか、それとも両生類全般に共通するものなのかを明らかにするため、広島大学両生類研究施設の協力も仰ぎ、系統的にも様々な3科4種の有尾類と4科10種の無尾類の原腸形成過程を比較した。
まず、以前と同様に胞胚腔への色素注入実験を行い、それぞれの種で内部組織による予定神経外胚葉の裏打ちが完了する時間を調べた。従来の説通りの原腸形成なら、裏打ちが終わるのは中期~後期原腸胚で、アフリカツメガエルのような原腸形成なら、初期原腸胚になると予想される。結果は、調査したすべての種において、初期原腸胚で裏打ちが完了していた。この時、胚の内部では遡り運動が起きている様子は確認できず、背側の内部組織の先端は胚の赤道面に位置していた(図2)。これは頭部が赤道面に形成されることを意味する。しかし、中軸中胚葉が胞胚腔の内部を遡っていき動物極に頭をつくる、という従来の説の根拠の1つにもなっているフォークトらの予定運命図では、予定神経領域は胞胚腔の屋根に位置しており3)、この観察結果は矛盾していた。そこで、局所染色により、アカハライモリ胚の裏打ち完了時間の背側の赤道面が、将来どの組織になるかを調べた。その結果、この赤道面は、神経胚期にはやはり最前方部の頭部神経に位置していた。さらに、裏打ちが完了する時間に胚の胞胚腔の屋根を除去したとき、どのように発生するかを一部の種で調べた。この屋根を除去した胚でも、我々の結果から予想される通り、頭部を含む神経がきちんと形成され、腹側の表皮だけがなくなっていた。よって、これらの結果は、赤道面に頭部を形成するという、胞胚腔への染色実験から得られた結果を支持している。
なぜ、多くの研究者によって検証されている予定運命図と、我々の観察結果が異なるのか?その原因を探るため、チョウセンスズガエルの色素注入胚を様々な時間で固定し、胞胚腔の屋根の染色領域がどのように推移するか観察した。その結果、裏打ち完了時間の前に、胞胚腔の屋根が大きく原口の近くまで下がってくることがわかった。これは、原腸形成運動の1つの覆い被せ運動という動きによるものと思われる。つまり、予定運命図は覆い被せ運動が起きる前の胚で作られたもので、裏打ち完了時間までには、予定神経領域は赤道面より下に降りてきているために我々の結果と矛盾が生じた、と考えられる。そこで、この仮説を検証するため、アカハライモリ胚の裏打ち完了3時間前の背側赤道面が将来何になるかを調べたところ、上記とは異なり、頭部ではなく、胴体部の神経になっていた。また、一部の種で、裏打ち完了時間前に胞胚腔の屋根を除去すると、神経自体が形成されなかったり、形成されたとしても後方部の神経だけで、頭部は形成されなかった。これらの結果は我々の仮説と一致する。
アフリカツメガエルでは、裏打ち完了後、予定頭部神経領域と裏打ちしている内部組織は、その後の原腸形成期中もずれずに接触を維持していることが示されている1)。しかしながら、観察したすべての種で、我々が今回決定した裏打ち完了時間以後に、動物極方向へ遡る内部組織が観察された。そこで、裏打ち完了時間にイモリ胚の背側赤道面を局所染色するとともに、そのちょうど裏側に位置する内部組織にビーズを移植し、その後の原腸形成過程で両者の位置関係が変化するかどうかを観察した。その結果、神経胚初期に観察しても両者の位置関係は変化しておらず、お互いの接触は維持されたままであることがわかった。また、裏打ち完了時間に胞胚腔に色素注入したスズガエル胚を継時的に観察すると、外胚葉の染色領域の境界(=将来の表皮-神経境界)と内胚葉-中胚葉境界(細胞の色や大きさで区別可能)は、近接したままずれていかなかった。この結果は神経を誘導するオーガナイザーの能力をもつ背側中軸中胚葉は、予定神経領域との物理的接触を維持することを示唆する。この時、動物極方向へ時間とともに遡る組織が見られたが、これは中胚葉性ではなく内胚葉性の組織であり、咽頭内胚葉であると考えられる。ニホンアカガエルでも同様の結果が得られた。
ここまでの結果はアフリカツメガエル同様、他の両生類でも頭部の場所を初期に決定後、もともとの植物極側に背側構造を作っていることを示唆していた。そこで、様々な両生類の胚をゼラチンに包埋し、重力による自由回転を抑えた状態でタイムラプス撮影し、原腸形成の様子を観察した。すると予想通り、観察したどの種の胚でも、背側の原口が腹側の原口の方へ近づいていくようにして卵黄栓が閉じ、背側構造が植物極側に形成された。以上の結果より、以前我々が示した従来の解釈と異なる新たな原腸形成運動のモデルは、アフリカツメガエルだけでなく、両生類全般に当てはまるものと考えられる。
ツメガエル胚の尾部形成機構の解明
ある組織が尾部のオーガナイザー活性を持つかどうか検証する場合、胞胚期や原腸胚初期の胞胚腔にその組織を移植し、異所的に新たな尾部が形成されるかを見る方法などが使われている4, 5)。しかし、移植をするためには形態形成の重要な時期の胚に傷をつける必要があり、その傷は尾部形成に重要な役割を果たすFGFシグナルの、下流にあるERKの活性化を引き起こすことが知られている6, 7)。また、単純な同所的移植でも異所的な尾が形成されたという報告もあり8)、実は異所的な尾部を誘導するのに、移植片の活性は必要ないのかもしれない。この可能性を検証するため、原腸胚初期に胞胚腔の屋根に傷をつけ、そのまま何も移植せずに、傷が開かないよう動物極側を下にして育てた。その結果、本来の尾に加えて異所的に尾部様の組織が形成された。この尾部様の組織はオタマジャクシ期には、本来の尾と独立にぴくぴく動くことが確認され、また、内部には神経管や、場合によっては脊索様の構造も認められた(図3)。
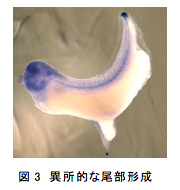
この尾部様の構造が、第2の尾部なのかを確かめるため、数種類の尾部のマーカー遺伝子が発生中の尾部様構造で発現しているかを神経胚期や尾芽胚期の胚で調べた。その結果、これらの遺伝子は、本来の尾部と同様の発現パターンでこの尾部様構造にも発現しており、これが第2の尾部であることが示唆された。また、FGF受容体の優性抑制変異型を胞胚腔の屋根に過剰発現させ、FGFシグナルを阻害すると、この第2の尾部の形成は阻害された。これらのことから、第2の尾部は本来の尾部と同じ機構で形成されると考えられる。
次に、第2尾部形成の初期段階を解析するため、傷をつけた胚で原腸胚期に異所的な遺伝子発現を調べた。その結果、傷をつけた後、3.5時間でXbraやflrt3の発現が認められ、その発現するまでの時間の短さから、これらの遺伝子が最初に誘導される遺伝子であると推察された。その後、7時間で、Xnotやcdx4、chdといった遺伝子の発現も検出された。
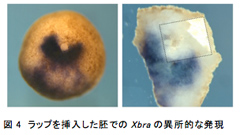
第2の尾部はどのような条件で形成されるのか?上記の方法の一部を様々に変更したところ、原腸胚中期以降に傷をつけた場合や、膜を残したまま傷をつけた場合は第2の尾部は形成されず、動物極側を下にせずに上向きのまま育てた場合は、形成される確率は半分になった。このことから、第2の尾部を形成するためには、原腸胚中期前までに胞胚腔の屋根が胞胚腔の床に物理的に接触する必要があるということが示唆された。これが正しいか検証するため、屋根に傷をつけた胚の胞胚腔に、小さく切った食品ラップを挿入し、胞胚腔の屋根の一部が床に直接接触しない状態にして育て、Xbraの発現を調べた。その結果、胞胚腔の屋根に異所的なXbraの発現は見られたが、一部が欠けた状態で、その欠けた部分の胞胚腔側にはラップが張り付いていた(図4)。よって、この方法による第2の尾部形成には胞胚腔の屋根と床の接触が必須であることがわかった。
膜を残したまま傷をつけた場合は第2の尾部が形成されなかったことから、もしかしたら傷自体は第2の尾部形成に必要ないのかもしれない。そこで、傷があった場所が第2の尾になっているか調べるため、傷口を染色し、動物極に傷をつけた場合と、赤道付近につけた場合とで比較した。その結果、動物極に傷をつけた場合は、第2の尾部の中に染色が認められ、赤道付近を傷つけた場合は第2の尾部と全く関係ない場所で染色が見られた。このことから、傷は胞胚腔の屋根と床の接触を可能にしただけで、傷自体は第2の尾部形成に直接関与していないと考えられる。
発生過程において、正しい形態形成が次の正しい遺伝子発現を導くと言われている。本来の尾が形成される場所は、神経外胚葉、中軸中胚葉、内胚葉など様々な組織が密に詰まった場所である。胞胚腔の屋根と内胚葉を組み合わせて培養すると中胚葉ができるのは有名な話であり、この異所的な尾部が誘導されるところにも外胚葉、中胚葉、内胚葉が揃っている。今回の我々の実験は、尾が形成される"場"を人工的に再現したことで第2の尾部が形成されたのではないかと考えている。もしかしたら尾部オーガナイザーというものは存在せず、ある"かたち"ができたときに尾を作り出しているのかもしれない。
脊椎動物の頭部構造はどのようにできるのか?
脊椎動物の頭部は構造の複雑性および特殊性から「真の頭部」と呼ばれ、無脊椎動物の頭部と区別される。そのため、脊椎動物の頭部は脊椎動物を定義すると言っても過言ではない。我々が解析を行っているヌクレオチド受容体P2Yは、ツメガエル初期胚において頭部形成に重要な時期および領域で発現することをこれまで明らかにしている。また、P2Y受容体の翻訳を特異的に阻害すると、頭部形成が正常におこなわれないことも昨年度明らかにした。今年度は、P2Y受容体の中でも、頭部形成への関与が示唆されているP2Y1、P2Y4、P2Y11の3つのサブタイプについてin situハイブリダイゼーション法による包括的かつ詳細な時空間的発現パターン解析を行なったところ、三者共に神経堤・プラコード・頭部神経に関連する領域に発現が認められた(図5, 6, 7)。
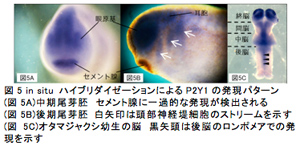

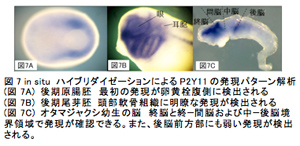
また、アンチセンスモルフォリノオリゴ(MO)による翻訳阻害及び人工ヌクレアーゼ(TALEN)を用いた遺伝子破壊実験9)により頭部形成への影響を解析した。発現パターンの解析結果から、P2Y1、P2Y4、P2Y11は頭部神経や眼、神経堤、頭部感覚器(プラコードに由来する)の発生に関与することが推察される。そこで、各P2Y受容体の翻訳を阻害するMOを作製し、4細胞期の背側片側割球に顕微注入した機能阻害胚の解析を行なった。
まず、眼や脳の奇形および著しい萎縮がみられたP2Y1およびP2Y11 のMOによる機能阻害胚について、頭部神経系発生のどの段階にこれら2つの受容体が寄与しているのかを解析した。昨年度は「眼」や「脳」の形成に関わる数種のマーカー遺伝子について、その発現にP2Y1およびP2Y11の機能阻害が与える影響を解析してきた。今年度は機能阻害胚の形態的な観察から、レンズの形成不全とレンズ周囲の層構造の奇形、終脳の萎縮、脳胞の形成不全に焦点を絞って解析を行なった。まず、眼のマーカー遺伝子の発現解析を行なった。網膜マーカーであるsix6やレンズマーカーであるL-maf、FoxE3についてはP2Y1およびP2Y11の機能阻害によって、その発現が明らかに減少もしくは消失していた。これらのマーカー遺伝子の発現低下は初期尾芽胚から後期尾芽胚にかけて観察され、P2Y1およびP2Y11の双方が眼形成の初期段階から関与していることが強く示唆された。また、前脳のマーカーであるFoxG1も初期尾芽胚から後期尾芽胚にかけてP2Y1およびP2Y11の機能阻害によってその発現が減少した。これらのマーカー遺伝子の発現低下は、眼の形成不全や前脳に由来する終脳が萎縮する形質と一致する。眼や終脳は同じ神経外胚葉に由来するため、これらの形成が正常に起こらないことが他の脳領域の形成に影響する可能性は高いと考えられた。この仮説が正しければ、脳の領域化に異常をきたしたことで脳胞の形成不全(間脳、中脳、後脳の節構造が形成されない形質)が引き起こされていると考えられる。そこで、昨年度に解析した脳のマーカー遺伝子であるPax6、Otx2、Hesx1などのデータについて再度考察を行なった。昨年度には、初期神経胚期のP2Y1およびP2Y11の機能阻害側では眼の形成に関わるOtx2やPax6は発現が低下し、尾芽胚期にはその発現の変化は一時的に観察できなくなることが明らかになっていた。また、尾芽胚期には機能阻害側で抑制性の転写因子Hesx1の発現領域が拡大していた。Hesx1は神経胚初期には予定神経前方領域の広い部分に発現し、その後発現が一部に限局して、Otx2やPax6の発現を抑制することが知られているため、機能阻害胚では初期のHesx1が本来消失すべき場所で残り続け、Pax6やOtx2の発現を異所的に抑制することで、眼の形態異常が起きているのかもしれないと考えた。しかし、Otx2やPax6の発現低下が尾芽胚期には一時的に観察できなくなる原因や、Hesx1の発現領域拡大が起こる時期などについての解析が不十分であったため、これらのマーカー遺伝子の発現についてより多くのサンプルを観察した。その結果、尾芽胚期の機能阻害側におけるOtx2やPax6の発現は消失していることはなかったが、減少しているものと拡大しているものがみられ、コントロール側と比較した場合に発現領域に明らかな差異が認められた。また、機能阻害側におけるHesx1の発現領域拡大はHesx1の発現開始時期とほぼ同時の神経胚期から確認され、後期尾芽胚期まで観察された。これらの事実と、脳胞の形成不全という形質、影響の出るマーカー遺伝子が多種に渡ることを考え合わせると、神経外胚葉が領域化していく初期の過程からP2Y1やP2Y11はさまざまな遺伝子の発現領域の住み分けに間接的に関与している可能性が高いと考えられた。
次に、昨年度までの解析ではMOによる機能阻害実験では十分に遺伝子発現を低下させられず、形質が安定しづらいP2Y4についてTALENを用いた遺伝子破壊実験を行なった。また、これまでのMOによる機能阻害実験のデータについて再現性が得られるかを調べるために、P2Y1とP2Y11についても遺伝子破壊実験を行なった。その結果、約1%という低い生存率ではあったがP2Y4の遺伝子破壊によって頭部が形成されない個体が得られた(図8)。後期尾芽胚まで発生は進んだが、耳胞や眼などの頭部構造が一切確認できなかった。P2Y4の発現領域は主に頭部神経堤であり、頭部構造の多くの要素が欠損した個体が得られたことは、発現パターン解析結果と一貫性がある。P2Y1とP2Y11の遺伝子破壊については、頭部が形成されるステージまで発生する個体が得られなかった。この原因は、P2Y1とP2Y11はどちらも中胚葉に発現しており原腸形成過程で何らかの影響が起こっているものと考えられる。今後は、まずP2Y4の頭部欠損個体を安定的に得ることと、P2Y1およびP2Y11の遺伝子破壊形質を確認することを目標にして条件検討を行っていく。

おわりに
両生類における原腸形成運動は、我々が以前から示しているツメガエルのモデルに等しく、原腸形成初期ですでに最前方部のオーガナイザー(中軸中胚葉)組織と予定頭部神経領域が物理的に接すること、さらにこれらの組織は原腸形成運動のあいだ互いに接したままであることが示された。興味深いことに、中軸中胚葉と予定頭部神経組織の裏打ちが起こった時に、有尾両生類ではある程度の原腸が形成されているにもかかわらず、無尾両生類では原腸はほとんど形成されていない。この事実は、原腸形成運動にともなう内部細胞群の運動と原口の形成の時期が有尾両生類と無尾両生類の間でずれていることを意味するのかもしれない。この推測は、オーガナイザー関連遺伝子の発現パターンの変化などを詳細に見た結果から指示される。これらは、異なるように見える有尾と無尾の原腸形成様式がそれぞれ異なる二種類以上の素過程の組合わさりによって考えることで、互いに共通の機構からなっていることを示している。このような、有尾と無尾の原腸形成過程における際は他にもあり、たとえば、尾部オーガナイザーが提唱された実験は有尾両生類を用いており、同様の実験ではツメガエルで尾部オーガナイザー様の活性は見いだされていないことなどがあげられる。実際に胞胚腔の屋根を傷付ける今回の実験でツメガエルと同様に尾部の重複が見られたのは無尾両生類種のみであり、アカハライモリを含む有尾両生類胚での尾部重複は観察されなかった。これは、有尾両生類に見られる尾部オーガナイザー機能を有する領域は、実際は尾部オーガナイザーと呼ばれるような特異的な機能領域ではなく、脊索や神経外胚葉・内胚葉などの組織が今回の実験で見られたように密に並んだ構造であり、これが二次的に尾部構造を形成しただけかもしれない。
頭部構造を形成するのに関わる様々な時期や領域で発現するP2Y受容体は頭部構造の形成に関わることが示された。これら受容体は、その配列から脊椎動物にしか存在しないと考えられており、脊椎動物を定義する頭部構造の形成に密に関わる機能との相関が興味深い。ただ、TALENによる遺伝子破壊は初期胚致死をもたらすために方法論の改良が必要である。
参考文献
- 1)Koide, T., Umesono, K., Hashimoto, C., 2002. When does the anterior endomesderm meet the anterior-most neuroectoderm during Xenopus gastrulation? Int. J. Dev. Biol.
- 46, 777-783
- 2)Pyron, R.A., Wiens, J.J., 2011. A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians.
- Mol. Phylogenet. Evol. 61, 543-583
- 3)Vogt, W., 1929. Gestaltungasamalyse am Amphibienkeim mit ortlicher Vitalfarbung. Arch. Entw. Mech. Organ. 120, 384-706
- 4)Gont, L.K., Steinbeisser, H., Blumberg, B., de Robertis, E.M., 1993. Tail formation as a continuation of gastrulation: the multiple cell populations of the Xenopus tailbud
- derive from the late blastopore lip. Development. 119, 991-1004
- 5)Slack, J.M., Isaacs, H.V., 1994. The Einsteck-method: position and structure of projections formed by implants of a ventral character. Dev. Biol. 161, 313-317
- 6)LaBonne, C., Whitman, M., 1997. Localization of MAP kinase activity in early Xenopus embryos: implications for endogenous FGF signaling. Dev. Biol. 183, 9-20
- 7)Christen, B., Slack, J.M., 1999. Spatial response to fibroblast growth factor signalling in Xenopus embryos. Development. 126, 119-125
- 8)Kornikova, E.S., Korvin-Pavlovskaya, E.G., Beloussov, L.V., 2009. Relocations of cell convergence sites and formation of pharyngula-like shapes in mechanically relaxed
- Xenopus embryos. Dev. Genes. Evol. 219, 1-10
- 9)Suzuki, K. T., Isoyama, Y., Kashiwagi, K., Sakuma, T., Ochiai, H., Sakamoto, N., Furuno, N., Kashiwagi, A., Yamamoto, T., 2013. High efficiency TALENs enable F0 functional
- analysis by targeted gene disruption in Xenopus laevis embryos. Biol. Open, 2, 448-452
