年度別活動報告
年度別活動報告書:2014年度
両生類の原腸形成運動と頭部構造の形成
橋本 主税(主任研究員) 原田 綾乃(奨励研究員)
楊 貴成(大阪大学大学院生) 守 翔子(研究補助員)
はじめに
脊椎動物の形づくりにおいて、卵形成から原腸胚に至る過程は種によって様々であるが、原腸形成過程を経ることにより種を越えて互いに似た形を作ることが知られている。実際に咽頭胚の形は脊椎動物の種間で高度に保存されており、この形を作ることが脊椎動物の個体発生に必須の事柄であるとすら言えそうである。両生類の原腸形成過程では、初期原腸胚の原口背唇部に位置するオーガナイザーと呼ばれる機能領域が、原口を通って内部領域と陥入し、胞胚腔の屋根を裏打ちするかたちで頭部方向へとさかのぼることにより、動物極周辺に頭部が決まるとされている。しかし、アフリカツメガエルを用いた我々の研究から、そもそもオーガナイザーのさかのぼり運動はほとんど見られないこと、予定頭部領域は動物極周辺ではなく赤道部分にあることなどが明らかとなり、原腸形成運動自体を見直す必要性が生じてきた。
脊椎動物の成り立ちを考えるために、我々は今年度、大きく二種類のテーマを掲げて解析を進めた。第一に、両生類の原腸形成運動を統一的に理解するモデルの構築と、そのモデルから脊椎動物の原腸形成過程を統一的に説明することが可能であるかについての検討、第二に、脊椎動物を脊椎動物たらしめている頭部構造を形成する意味で最も重要である神経堤・プラコード・頭部神経などがどのような機構で誘導を受けるのかについてP2Y受容体を指標として解析することである。また、両生類の形づくりの研究をさらに進展させるための予備実験として、両生類胚で効率的に働くCRISPRシステムの構築を進めている。さらに、卵母細胞を種々の発生段階に分け、それぞれに発現するRNAを次世代シーケンサーで解析することにより、卵形成過程と胚発生の関係を探る試みを開始している。
結果と考察
オーガナイザーと予定頭部神経が接する時期と場所
両生類の初期原腸胚の表層には「オーガナイザー」と呼ばれる神経を誘導する組織が存在する。この領域は原腸形成運動の間に内部に潜り込み、動物極方向へさかのぼる運動を行ない、原腸形成運動の完了と共に接している外胚葉に働きかけ神経を誘導する。このオーガナイザーのさかのぼり運動は、両生類共通のものと考えられてきた。しかし、我々はアフリカツメガエルにおいてはこの運動は起こらず、頭部神経誘導活性を持つ領域は胚の赤道部分で予定神経外胚葉と接していることを証明した1)。更に、広島大学両生類研究施設の協力のもと、アフリカツメガエルと同様な実験を3科4種の有尾類と4科10種の無尾類に対して行なった結果、調査した全ての両生類においてアフリカツメガエルと同様にさかのぼり運動は起こっていないことも明らかにし、原腸形成を統一的に説明するあたらしいモデルの構築に成功した。
従来の原腸形成モデルにおいては胚の動物極に将来の頭部が形成されると考えられていた。実際、フォークトによる局所生体染色方法を用いた実験によると2)、オーガナイザーがさかのぼった先にある、胞胚の時期の動物極にある細胞が最終的には頭部領域になるということが示されている。それにもかかわらず我々は、そもそも「さかのぼり運動」自体起こらないということを証明できた。この矛盾の原因を追求するべく、胚の内部構造について深く理解を進めていくと、初期原腸胚において将来頭部になる細胞群は胚の背側赤道部分に存在していることが分かった。つまり、将来の頭部領域になる細胞群が、胞胚から初期原腸胚の時期にかけて動物極から背中側の赤道領域まで下がってきていることが示唆された。この動きは原腸形成運動の1つである覆い被せ運動によるものと考えられる。覆い被せ運動自体は様々な論文で証明されてきたが3, 4)、この動きにより将来の頭部領域になる細胞群が下がってくることはある種の盲点だったのかもしれない。
以上の実験結果から、従来の原腸形成運動モデルがどの両生類にも適さない可能性が高まり、モデル自体を見直す必要が生じた。両生類における共通性を確かめるため、以降の実験は無尾両生類の代表としてアフリカツメガエルを、有尾両生類の代表としてアカハライモリを用いて行ない、実験結果から共通性を導き出した。
まず、神経誘導領域が各発生段階において胚のどの位置に存在しているかを観察するために、神経誘導領域のマーカー遺伝子chordinを用いてin situ ハイブリダゼーションを行なったところ、図1で示したように、原口が出現する前の胞胚の時期に胞胚腔の屋根の部分に既にchordinが存在していた。更にその後chordin発現領域は、覆い被せ運動により上から押されて徐々に下がっていく。これまでは原口背唇部の表層のみが神経誘導領域であるとされてきたが、実際には胞胚腔の床にまで神経誘導領域が広がっていることが判明した。そして、胞胚腔の床の部分が、覆い被せ運動によって降りてきた将来神経となる予定神経外胚葉と接する様に動いている様子がこの実験から推測された。予定神経外胚葉と神経誘導領域の接する過程を注意深く観察すると、2つの領域の境目を支点としてVの字を閉じるような動きをしているように見て取れた。そこでこの動きが実際に存在するか確かめる為に、Vの字が閉じる前に胞胚腔の床にビーズを置きその後の発生を観察した。その結果、支点に近いところにビーズを置くと、原口により近い植物極側に挟まれており、支点から離れるとより動物極に近い部分に挟まれている様子が観察され、胞胚腔の床が支点からの距離依存的に、予定神経外胚葉に接していることが示唆され、我々がin situ ハイブリダイゼーションの結果から想定していたVの字を閉じるような動きが実際の動きとして存在していることが証明できた。

我々はこの動きを"Subduction (引きずり込み) and Zippering (締め上げ)運動"と名付けた(図2、以下S&Z運動と表現する)。 Subductionとは大陸プレートの沈み込み運動のことを指す単語であり、神経誘導領域が覆い被せ運動により、予定神経外胚葉に近づく様子を表している。またZipperingとはチャックを締める動作を指す単語で、神経誘導領域と予定神経外胚葉が徐々に接していく様子を表している。この新しい組織運動を提唱する論文を現在Developmental Biology に提出し査読審査中である。
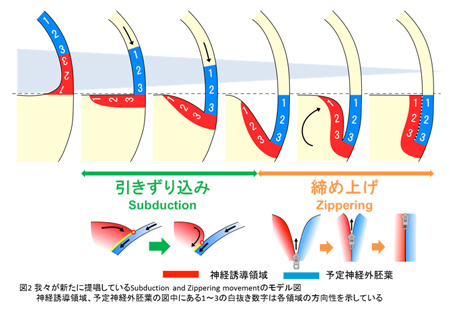
S&Z 運動を提唱するにあたり、過去の膨大な実験事実と整合性が取れるかが最大の関心である。考察するべき点は様々あるが、今回は今後の研究計画に最も関わりが深いと思われる点に関して言及する。前述した通り「神経誘導領域のさかのぼり運動」というものは存在しないが、原腸形成運動の最中「さかのぼる組織」というものは存在している。代表的なものは原口を形成するのに重要な役割を担っているボトル細胞という組織が挙げられる。この組織は我々が提唱するS&Z 運動が起こった後に、この領域を追い越す形でさかのぼっていると考えられるが、胚内部における詳細な動きに関しては正確に観察できていない。その為、今後は蛍光染色液を用いて胚の各部位を染色し、原腸形成運動の最中の各部位の動きのタイムコースを取り具体的な比較理解を深めていきたい。
脊椎動物の頭部構造はどのようにできるのか?
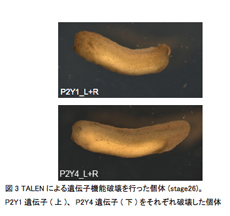
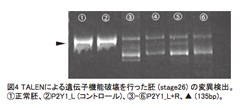
今年度は上記の結果の詳細な検証を行なうために、人工ヌクレアーゼ (TALEN)5)を用いた遺伝子機能破壊実験の方法論の確立を進めてきた。P2Y1と11に関してはアンチセンスモルフォリノオリゴ(MO)による機能阻害実験から2つの受容体と頭部構造の形成の関連が強く示唆されていたが、P2Y4については十分に遺伝子の発現を低下させることができず、安定した表現型が得られなかった。そこで遺伝子機能破壊を行なったノックアウト胚を用い、P2Y4の頭部構造形成における機能解析を目的としている。またP2Y1およびP2Y11についても、MOによる遺伝子機能阻害実験から得られた結果の再現性を得ることを目指している。昨年の予備実験の結果では、遺伝子破壊を行なった胚はP2Y1と11については、原腸形成過程前で致死に至り頭部構造への影響は確認できていなかった。P2Y4については約1%と非常に低い生存率で生き残り、後期尾芽胚期まで発生が進行した胚については、耳胞や眼胞などの頭部構造が形成されないという結果が得られていた。P2Y4の発現領域は主に頭部神経堤であったため、神経堤由来の頭部構造が形成されないというノックアウト胚の結果は矛盾がないと考えている。P2Y1やP2Y11は、形態形成で重要な時期である原腸形成期過程で中胚葉に発現するため、これら遺伝子の機能破壊を行なうことは胚発生や生存に大きな影響が出ることが考えられる。遺伝子機能破壊を行なった胚の生存率が低かったため、胚へ顕微注入するTALENの濃度検討を行ない、P2Y1とP2Y4については後期尾芽胚期で約70%が生存可能である条件を設定した。P2Y1の遺伝子破壊を行なうと、原腸形成期までは形態において目立った異常は確認されなかったが、それ以降は前後軸の伸張が短く、背側が曲がった胚が多く確認された (図3上)。また眼胞や耳胞が萎縮しており、頭部の構造も全体的に縮小する傾向が見られた。P2Y1の発現が脊索や頭部構造に発現するという事実からも6)このような表現型は、遺伝子の機能が阻害された結果として形態異常が起こっていると考えられた。また、P2Y4の遺伝子破壊を行なうと頭部構造が縮小しており、眼胞や耳胞の萎縮が確認され昨年度の結果とほぼ一致している (図3下)。P2Y1ノックアウト胚については、表現型が確認できた胚からゲノムDNAを抽出し、TALENの標的となっている配列を対象としてPCR法により増幅し、ポリアクリルアミドゲルで泳動し、コントロール胚との比較を行なった。TALENにより遺伝子破壊を行なった胚については、数本のバンドが検出された。下にシフトしているバンドはTALENによる塩基の欠失によるものと考えられる。これより、TALENの標的配列部分において何らかの変異が生じていることが示唆された。現在、P2Y4ノックアウト胚についても同様の解析を行なっており、またゲノムDNAの配列を調べ、TALENの標的配列部分が実際に欠失しているか否かの詳細な解析も進行中である。塩基の欠失を確認しTALENによる遺伝子破壊実験の条件を確定させ、今後はこれらのノックアウト胚を用いて、P2Y受容体の神経外胚葉における領域化や神経堤発生あるいは神経堤細胞の維持への関与を明らかにしていきたいと考えている。
両生類胚におけるノックアウト技術の確立
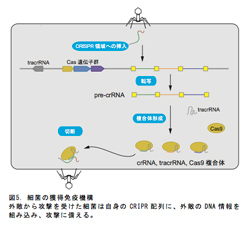
遺伝子の機能について解析する際、多くはその遺伝子をノックダウンさせるためにMOやトランスポゾン等を用いてきた。この技術は非常によく使われているが、技術的に難しい、コスト面で高くつく、細胞毒性といった問題がある。また、遺伝子をノックダウンさせるのであって、完全に遺伝子の働きを阻害しているわけではないということに起因する問題点もある。このような問題点から、最近ではゲノムを直接、編集することができる、TALENやCRISPRシステムといった技術が非常に注目を集めている。特に、TALENよりも容易にできるとされているCRISPRシステムに注目が集まっている。これらの技術は先に述べたMO等よりも毒性がなく、より遺伝子をノックアウトさせることができるとされているため、多くの研究者がこのゲノム編集技術を取り入れて研究を行なっている5、7)。両生類においては、ネッタイツメガエルで成功したことが報告されているが、アフリカツメガエルやアカハライモリではまだ報告がない8)。そこで、本研究ではアフリカツメガエルやアカハライモリでCRISPRシステムを使ったゲノム編集を行なうための実験系の確立をめざした。
CRISPRシステムはもともとバクテリアといった外敵から細菌自身が身を守るためにある獲得免疫システムである(図5)。このシステムを利用し、遺伝子の特定の領域を標的とした配列を持つguide RNA (gRNA)と、これを目的の配列まで誘導し、DNAを切断するCasタンパク質をコードするmRNAを細胞や卵に導入させることで遺伝子のノックアウトをすることができる。
本研究では標的の遺伝子としてメラニン生成に関わるチロシナーゼ遺伝子(tyr)を選定した。この遺伝子をCRISPRシステムで破壊することができれば、黒い色素を作ることができなくなり、白いアルビノ胚を得ることになり、顕微鏡下で容易に確認することができるからである。このtyrの塩基配列の情報をもとに、gRNAを作成することにした。これまで報告されている論文ではこのgRNAは標的遺伝子の配列(標的配列)を含むDNA断片をPCR法により作成し、これをベクターに導入してプラスミドを作成し、そこからRNAを合成するという方法が用いられている。この方法は導入するためのベクターが必要になり、導入した後もプラスミドを増やすために手間も時間もかかってしまう。そこで、4種類のオリゴプライマーとPCR法により断片のみをRNAが合成できるまで増幅させ、RNAを作成することに成功した(図6)。これにより、大幅な時間の省略を行なうことができた。
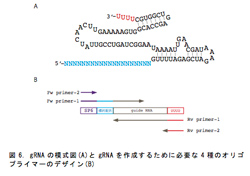
作成したtyr gRNAをアフリカツメガエルとアカハライモリに顕微注入した。アフリカツメガエルでは影響は見られなかった。アカハライモリでは色素胞が小さくなったものを観察することができた。
これまでの研究からなぜ、完璧なノックアウトができなかったのか、今後はどのような研究を行なえばいいのかについて以下に述べる。
<gRNAの標的配列の選び方について>
標的配列はPAM配列と呼ばれる3つのNGG配列(Nは任意)を後ろに持つ20塩基の領域を選ぶことになっている。つまり、この標的配列がDNAに結合しなければノックアウトは起こらない。そこで、本研究では上流側に標的配列を設定することで、DNAが切断され、転写が阻害されることを狙ったものであった。しかし、今回の結果からtyrのノックアウトはできていないことが明らかであり、切断がうまくいかなかったのか、切断はうまくいったがこの領域を切断することは意味がなかった、のどちらかということになる。アフリカツメガエルでTALENを使ったノックアウトの論文ではtyrドメインの上流側を切断するように設計されていた。このことから、同じ領域を切断するgRNAを設計する必要がある。また、gRNAは20塩基と非常に少ない塩基数で標的配列に結合することから、全く実験に関係ない遺伝子までノックアウトしてしまう恐れがある。標的配列の認識にはPAM配列側の十数塩基が重要であるという報告もあり、確実なノックアウトをさせるために20塩基ではなく、もっと塩基数を増やすことで結合に特異性をうませるというのも手だろう。
<ゲノム編集と生物の倍数性の関係性>
DNAを切断することにより、遺伝子をノックアウトさせることを目的としているので、確実に遺伝子を切断するためにはその動物が持つゲノムにも着目しなくてはならない。本研究で使っているアカハライモリは2倍体、アフリカツメガエルは偽4倍体である。ゲノム編集がうまくいっている動物は2倍体が多く、つまり、倍数が多くなればそれだけ切断しづらいと考えられる。アフリカツメガエルにおいてCRISPRシステムの系を動かすためには、gRNAとCasの複合体が長い時間、胚の中に存在し、切断することができる環境を作るというのが妥当だろう。
<Casタンパク質の働きに関して>
Casタンパク質の働きはgRNAを標的配列まで誘導し、DNAを切断することである。この働きだけではなく、分解されやすい構造であるgRNAを保護することもしているだろう。よって、gRNAとCas mRNAを同時に胚に顕微注入してもCasタンパク質が合成されるまでにgRNAは分解されているかもしれない。これらを解決するためにはCasタンパク質を持つトランスジェニックガエルの作成等が良いだろうが、アフリカツメガエルは次世代を作るまでに非常に時間がかかるので、即効性がない。よって、考えられるのは、Casタンパク質の顕微注入、もしくはgRNAを再度注入する方法であろう。これならば、トランスジェニックガエルを作成するよりも早く、そして簡単にCRISPRシステムの実験系を確かなものにすることができるだろう。
卵形成過程と個体発生との関係
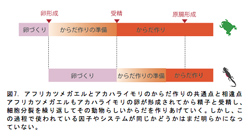
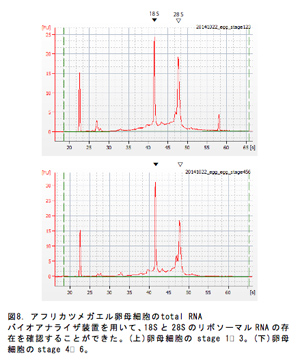
多くの動物は球状の卵母細胞ができ、その後、受精・原腸形成といった現象を経て、その動物が持つべきからだを手に入れる。同じ両生類でも発生の様式には共通点もあれば相違点もある。イモリとツメガエルの初期発生過程を比較すると、遺伝子発現の時期や場所など基本的な分子機構が異なるように感じられる点が多々見えてきている(図7)。また、基本的に重要であると考えられるシグナルなどにも違いがありそうである。たとえばイモリではβカテニンシグナルは体軸誘導に機能せず、ツメガエルではその下流に存在するホメオボックス型転写因子siamois/twinもイモリには見つからない9)。我々は、これらの違いが胚発生以前の段階、すなわち卵形成過程に原因があるのではないかと考え始めている。両生類の卵には様々な「形」が存在する。それは転写因子や成長因子、あるいはシグナル伝達因子などの局在や濃度勾配によって現れる。受精以降の胚発生過程は、原則的にこの「形」にしたがって進むことから、卵形成過程も形づくりの一過程と位置づけることは重要であり、卵形成過程の違いが種間の発生様式の違いに関係すると考えることは可能であろう。たとえば、ツメガエルの発生はきわめて短時間に進むが、これなどは卵形成過程で主な「形」ができ上がっており、受精によってひとつの引き金を引くことですべてが一気に進むと考えることもできるのではないかということである。比較して、アカハライモリの発生は長い。この違いは卵の中にからだを作るための因子がツメガエルほど周到には準備できているかできていないかの違いではないだろうか。だからアカハライモリでは、受精後にツメガエルの受精卵がすでに持っている「形」を作らなければならないのではないか?この疑問を解決するために、ツメガエルの卵巣内にある卵母細胞を取り出し、そこからRNA抽出を行なった。ツメガエルの卵母細胞はstage 1からstage 6までの6段階に分けられる。今回は予備実験として、stage 1、2、3とstage 4、5、6の2つわけ、サンプリングした。バイオアナライザ装置を用いてtotal RNAの分解度を確認した結果、stage 1、2、3のサンプルではRNA Integrity Numberが8.1、stage 4、5、6では7.9であった(図8)。この値はtotal RNAの分解過程を10段階で表したものであり、きれいなRNAを抽出することができたことがわかる。このtotal RNAを用いてcDNAライブラリーの作成を試みた。RNAシークエンスを行なうためには長いmRNAをある程度の長さに切断する作業が必要になり、この長さを一定にすることで、より正確な配列を知ることができるようになる。しかし、今回は初めて行なったということもあり、一定の長さの断片を得ることができず、様々な長さのcDNAライブラリーができた。次世代シークエンサーMiseqを用いて読んだところ、20万リード数であった。
おわりに
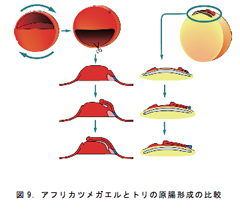
両生類の原腸形成運動を統一的に説明するモデルの構築が完了した。このモデルを丁寧に見ていくと、これまでの考え方では説明できない新たな動きの存在が予見される。たとえば原口背唇部の組織は前方部分の中軸中胚葉には決してならないのだが、この組織は原腸形成運動が終了するときには頭腸部に存在することも事実であり、ということは原腸形成過程のどこかで将来の頭部領域を追い越して動かなければならないのだが、この動きはこれまでに考えられていない。また、頭腸部に移動した原口背唇由来の組織はその後に咽頭内胚葉となることも知られており、咽頭内胚葉は頭部構造の形成に重要であることからもオーガナイザーと頭部誘導の新しい視点となりうるかもしれない。実際に原口背唇部を切除した胚は頭部形成不全となる事実も興味深い。我々が提案している新しいモデルは、トリの原腸形成過程と直接的に比較することを可能とする(図9)。ここで両生類型の原腸形成運動を行なうポリプテルスなどの魚類の原腸形成過程を両生類と比較検討することで、脊椎動物を統一的に説明できる新しいモデルの構築にいたるかもしれない。
脊椎動物の頭部構造の形成にP2Y受容体群が何らかの重要な機能を有していることが示された。これら受容体は、その配列から脊椎動物にしか存在しないと考えられており、脊椎動物を定義する頭部構造の形成に密に関わる機能との相関が興味深い。ただ、TALENによる遺伝子破壊は現時点ではうまく機能しているが、より簡便で確実性の高いCRISPRシステムの検討が必要となってきている。我々は、準備の簡単さなどからCRISPRシステムの両生類胚への導入を進めている。まだ予備実験の段階ではあるが、イモリ胚においてCRISPRシステムが機能しそうな手応えをつかんでいるので、特定割球だけで遺伝子破壊ができるなどの応用に向かうことができるようにさらに条件を検討したい。
最後に、イモリとツメガエルの初期発生過程の違いが卵形成過程にあるのではないかと考え、その可能性を確かめるために解析を始めている。実は、イモリとツメガエルにおけるβカテニンのような例は、種々のサカナの胚発生にも見られており、受精可能な卵母細胞がどのように形成されるのかを知ることが重要である可能性が高まっていると感じる。現在、卵形成過程をいくつかの発生段階に分けてそこに発現する遺伝子の網羅的解析を始めている。ひとまず卵形成から原腸胚に至るいくつかの段階で発現する遺伝子をイモリとツメガエル間で比較することにより、同じ遺伝子でも発現時期に差があるのかなどについて調べてみたい。
参考文献
- 1)Koide. T, Umesono. K, Hashimoto. C., 2002. When does the anterior endomesderm meet the anterior-most neuroectoderm during Xenopus gastrulation? Int. J. Dev. Biol.
- 46, 777-783
- 2)Vogt, W. 1929. Gestaltungsanalyse am Amphibienkeim mit örtlicher Vitalfärbung. II. Teil Gastrulation und Mesodermbildung bei Urodelen und Anuren. Wilhelm Roux Arch. E
- ntwicklungsmech. 120, 384–706
- 3)Winklbauer, R., & Schürfeld, M., 1999. Vegetal rotation, a new gastrulation movement involved in the internalization of the mesoderm and endoderm in Xenopus.
- Development 126, 3703-3713
- 4)Papan, C., Boulat, B., Velan, S.S., Fraser, S.E., Jacobs, R.E., 2007. Formation of the dorsal marginal zone in Xenopus laevis analyzed by time-lapse microscopic magnetic
- resonance imaging.Dev. Biol. 305, 161-171
- 5)Suzuki, K. T., Isoyama, Y., Kashiwagi, K., Sakuma, T., Ochiai, H., Sakamoto, N., Furuno, N., Kashiwagi, A., Yamamoto, T., 2013. High efficiency TALENs enable F0 functional
- analysis by targeted gene disruption in Xenopus laevis embryos. Biol. Open 5, 448-452
- 6)Shindo A., Hara Y., Yamamoto T. S., Ohkura M., Nakai J., Ueno N., 2010. Tissue-Tissue interaction-triggered calcium elevation is required for cell polarization during
- Xenopus gastrulation. PLos One. 5, e8897
- 7)Niu, Y., Shen, B., Cui, Y., Chen, Y., Wang, J., Wang, L., Kang, Y., Zhao, X., Si, W., Li, W., Xiang, A. P., Zhou, J., Guo, X., Bi, Y., Si, C., Hu, B., Dong, G., Wang, H., Zhou, Z., Li, T., Tan,
- T., Pu, X., Wang, F., Ji, S., Zhou, Q., Huang, X., Ji, W., Sha, J.,2014. Generation of gene-modified cynomolgus monkey via Cas9/RNA-mediated gene targeting in one-cell
- embryos. Cell 156, 836-843
- 8)Blitz, I. L., Biesinger, J., Xie, X., Cho, K. W., 2013. Biallelic genome modification in F(0) Xenopus tropicalis embryos using the CRISPR/Cas system. Genesis 12, 827-834
- 9)Lemaire, P., Garrett, N., Gurdon, J. B., 1995. Expression cloning of Siamois, a Xenopus homeobox gene expressed in dorsal-vegetal cells of blastulae and able to induce
- a complete secondary axis. Cell 81, 85-94
