年度別活動報告
年度別活動報告書:2015年度
両生類の原腸形成運動と頭部構造の形成
橋本 主税(主任研究員) 原田 綾乃(奨励研究員)
國本 拓也(大阪大学大学院生) 守 翔子(研究補助員)
はじめに
差異を考えると個体差に行きつく。しかし、アフリカツメガエルとしてひとつのカテゴリに入れられたらそこに共通性が見いだせる。個体差を排除して、互いの共通性を見ることで種としてのまとまりに入れられるのである。これがカエル(無尾両生類)のカテゴリに入れられたらカエルとしての、両生類として分類されれば両生類としての共通性が見いだされる。この「共通性」を求める作業とは、多様な中に存在する違いを排除することであり、普遍性とは多様性の中にしか存在し得ないと言われる所以である。
脊椎動物が進化の過程で出現したとき、現在のように多種多様であったとは考えられない。もちろんその個体発生の様式もひとつしかなかったであろう。しかし、長い時間を経てさまざまな変異がゲノムには導入された。その結果として発生過程も多様となり、種々の脊椎動物種が生じることとなった。しかし、その形態形成の様式を比較すると、たとえば卵の形態や卵割様式はかなり異なっているように見える。これは、卵形成過程には多様なゲノムの変異を受け入れる余地があったことを予想させる。対して咽頭胚と呼ばれる時期の形態は脊椎動物を通じて厳密に保存されているように見える。形が似ていることは、その形が作られる仕組みが似ていることを意味する。したがってゲノムに生じたであろう多様な変異が咽頭胚を形成する過程ではことごとく制限され淘汰されてきたように見えるわけである。このような発生過程が脊椎動物種を通して共通であり普遍的であるという事実、多様性が排除されてきたように見える事実から、原腸胚から咽頭胚に至る過程は進化的にはいかなる変異をも受け入れることができなく、この形態形成過程を踏むことこそがすなわち脊椎動物を形成することであるとも言える。
私たちはツメガエルの原腸形成過程を丁寧に解析し、それがこれまでに提唱されてきたモデルとは一線を画することを見いだした。その新しいモデルは、イモリを始めとする内外の十種を越える両生類にも適応できることが昨年度の結果から明らかとなり、両生類の統一モデルとして今年度公表することができた1)。今年度は、このモデルではまだ明確にできていない組織運動の詳細を明らかとすることとともに、このモデルの観点から魚類や羊膜類の原腸形成過程を見直す試みを開始した。
また、脊椎動物の成り立ちを考えるためには、脊椎動物を脊椎動物たらしめている頭部構造が個体発生過程でどのように形成されているのかについての解析も進めている。方法としては、頭部構造の形成にきわめて重要な働きをする神経堤細胞の成り立ちを知るために、その未分化生や多分化能に着目してその細胞周期との関係性を解析している。また、頭部構造の形成にきわめて重要な働きを有することが私たちの解析で明らかとなっているP2Y受容体の作用機序を明らかとし、それが進化的にどのような意味を持つのかについて調べている。特にこのP2Y受容体遺伝子は脊椎動物ゲノムにしか存在せず、それが頭部構造の形成に機能していることは興味深い。
結果と考察
オーガナイザーの挙動と原口背唇部の意味の解明
両生類の初期原腸胚の表層には「オーガナイザー」と呼ばれる神経を誘導する組織が存在する2)。この領域は、原口と呼ばれる窪みから胚内部に陥入し、動物極方向へさかのぼっていき、その最前方部が原腸胚中期から後期にかけて胞胚腔の屋根に存在している予定神経外胚葉に到達することにより将来の頭部領域が決定されるとされてきた。しかし、私たちの先行研究によって、このさかのぼり運動は実際には起こっておらず、将来の頭部は動物極ではなく赤道領域に形成されることが明らかになり、従来と異なる新たな原腸形成モデルが構築された3)。新モデルでは、覆いかぶせ運動によって降りてきた将来神経となる予定神経外胚葉と胞胚腔の床の部分がV字で閉じていくS&Z運動という運動が行なわれ(この二つの組織の物理的接触の確立をACEと呼ぶ)、このV字が閉じることでACEの時期に赤道領域において将来の頭部が決定されることがわかっている。しかし、新たな原腸形成運動モデルを提唱するにあたり、改めて胚内部における内部組織の詳細な動きについて調べる必要性が生じてきたので、アフリカツメガエルを用いることで新たなモデルにおける内部組織の挙動を明らかにした。
新たな原腸形成運動モデルにより、オーガナイザーは表層から入り込むことなく、オーガナイザー自体は胚内部に存在していることが示唆されたので、背側の胞胚腔の床を別の胚の腹側に移植したところ二次体軸誘導能を持つことが確認された。したがって、頭部オーガナイザーは胚の外部(原口背唇部)にはなく、内部(胞胚腔の床)に存在しているということが判明した。そこで、フォークトによる局所生体染色法を用いた実験において、胚の背側表層をいくら染色しても染まらない領域が存在するのだが4)、この領域が染まらない原因は私たちが新たに発見したオーガナイザーが内部に存在するからだと推測される。本当に染まらない領域が内部オーガナイザーに相当するのか確認するために、背側の胞胚腔の床にビーズを置きS&Z運動によってACEの時期にV字にビーズが挟まるようにし、その後の発生を経時的に観察した。その結果、フォークトの実験で染色されない領域にビーズが存在し、この領域が内部オーガナイザーであることが明らかになった(図1)。
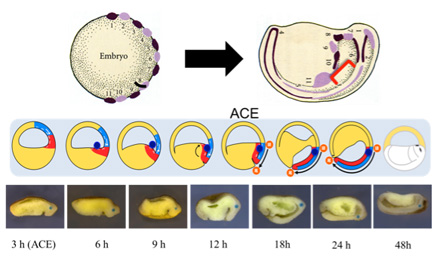
図1. アフリカツメガエルの胞胚腔の床にビーズを置きS&Z運動によりV字に挟ませた後、経時的に観察した図。
上段はVogtによる局所生体染色法によって、背側表層を数字の順に順次染色した胚(左)で発生が進むと、左図と対応するように染色されているが、赤カッコで示しているように染まらない領域が存在している(右)。中段は胞胚腔の床にビーズを置き、発生が進んでいく様子を表した予想モデル図。下段はモデル図の実験を実際に行なった結果。
また、従来のモデルでは体軸が尾部から頭部方向へ形成されると考えられてきたが、新モデルでは頭部領域でビーズがずれることがなく維持されたまま、体軸が頭部から尾部方向へ形成されていく様子が実際に確認することができた。加えて、ビーズの置いた外側の表層をNile Blueで染色し、ビーズを置いたすぐ外側をにじむことのないDiIをインジェクションすることで、ビーズがずれることなく維持されたままであることを保証することができた。さらに、その位置が頭部領域であることを確認するため、前脳マーカーであるotx2のin situ ハイブリダイゼーションを行なったところ、頭部領域にビーズが存在することが明らかになった。
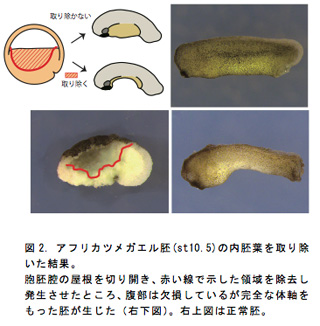
以上の実験結果で、先に頭部が決定された後、その位置が維持されたまま尾部方向へと体軸を形成すること、胞胚腔の屋根部分を完全に除去しても体軸形成が行なわれるという結果を同時に得ていることから、ACEによってできた将来の頭部領域があれば体軸を十分に形成でき、内胚葉は体軸形成において必要ない可能性があると予想できる。そこで、胚の将来の頭部領域を残し、内胚葉をほとんど除去したところ、腹部を欠損しているが完全な体軸を形成した胚が得られた(図2)。このことから両生類の胚体においても、鳥類と同様に背側から植物極周辺の表層のみでその形成には十分であることが示唆された。
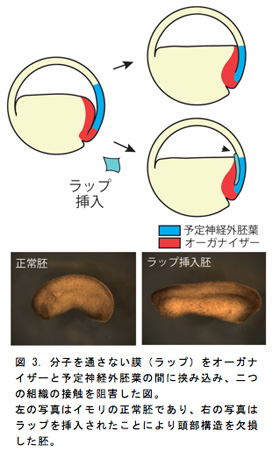
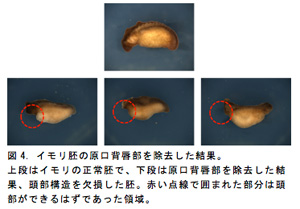
次に、S&Z運動によってACEが起こることで胚の頭部が形成されると考えられているが、もしこの運動による二つの組織の接触を阻害すると頭部が形成されないはずである。そこで、このV字の間に分子を通さない膜(ラップ)を挟み込むことで遺伝子の誘導を阻害したところ、頭部をもたない胚を得ることができた(図3)。この結果から、S&Z運動が胚の頭部形成に重要であることが明らかとなった。ところで、これまでに説明した将来の頭部領域と原口背唇部は直接接触しておらず原口背唇部は頭部の形成に関与していないように考えられていた。しかし、以前に、イモリ胚の原口背唇部を除去すると頭部構造を欠損した胚を得た実験結果がある(図4)。このことからACEが起これば頭部神経遺伝子が誘導されるにも関わらず、原口背唇部がなければ頭部構造は形成できないと考えられるので、頭部神経の誘導と頭部構造の形成の過程が別々であり、それぞれ異なるオーガナイザー領域によって制御されている可能性が示唆された。したがって、今後、原口背唇部の除去実験の再現性を確かめ、種々の頭部神経マーカー遺伝子の発現パターンを解析し、頭部構造形成との比較を行なう予定である。
卵形成過程と個体発生との関係
一つの細胞である卵が細胞分裂を繰り返し、増えた細胞が移動した先で器官を形成することでその動物らしい体ができあがっていく。しかし、この発生過程における全ての遺伝子の働きはどの動物でも同じタイミングで同じ働きをしているのだろうか。無尾両生類であるアフリカツメガエルでは、b-cateninやChordinは軸形成を行なう遺伝子として知られており、これらの遺伝子を単独で卵の腹側に顕微注入すると軸を2つ持つ胚を得ることができる5)。しかし、軸を形成する働きを持つ遺伝子をツメガエル胚にしたように、有尾両生類であるアカハライモリの卵にも顕微注入してみたが2つの軸を持つ胚を得ることはできなかった。それぞれの卵の大きさはイモリの卵のほうが大きいが、特に着目したのは発生速度である。2細胞期までに要する時間を比較すると、ツメガエルは1時間半後に卵割が始まるのに対し、イモリは7時間後である。これらより、イモリの軸形成はツメガエルの軸形成の機構とは異なり、これを調べるためにはツメガエルとイモリの卵にある遺伝子を比較することで手がかりがつかめるのではないだろうかと考えた。ツメガエル(Xenopus laevis)のゲノムデータベースは存在するが、イモリのゲノム解析はまだ行なわれておらず、本研究ではまず、イモリのゲノムデータベースを作成する必要が生じた。イモリのゲノム解析を本研究室で行なうには、技術的・人員的に難しく、どれほどのプロジェクトになるかさえも想像がつかない。そして、ゲノム解析の技術を得てから、本題であるイモリとツメガエルの軸形成機構の解析に取り組むというのはあまりにも壮大なプロジェクトであるため、やむなくゲノムデータベースを用いての研究は断念することとした。現在は他のアプローチ法がないかを模索している。
hairy2が細胞周期に関わる
脊椎動物のからだづくりを知るために頭部形成に着目してこれまで研究を行なってきた。頭部形成にはプラコード領域と神経堤が必要であるとされ6)、これらが存在することで頭部感覚器官を形成することできる。特に、これら領域を獲得した生物が脊椎動物であると定義されている7)。また、神経堤細胞は外胚葉・内胚葉・中胚葉に続く「第四の胚葉」として知られていて、最初は神経堤に局在しているが、発生が進むにつれて遊走し、胚体内の至るところに移動し、骨や色素細胞などを作ることが知られている。プラコードと神経堤はともに、表皮領域と神経領域の間のどちらともつかない組織から発生する。この領域で発現しているのがXhairy2である。Xhairy2はbHLH転写抑制因子をコードするHesファミリーに属しており、これまでにXhairy2はプラコードや神経堤の形成に関わることが分かっている。そして、興味深いのは、Xhairy2が発現している時は細胞周期を回しているが、Xhairy2の発現がなくなるとp27が働き始め、細胞が分化するということがわかっている。つまり、頭部神経での神経堤の未分化性の維持を制御しているのがXhairy2であると考えられる。

そこで、私たちはXhairy2が未分化性の維持や応答能の獲得に何らかの機能を担っているかについて調べるために、中胚葉誘導物質として知られているアクチビンを使うことにした。ツメガエル胚の胞胚期の動物極側には、アニマルキャップと呼ばれる将来外胚葉となる細胞層がある。この細胞群は切り出し、そのまま培養すると表皮になるが、10 ng/mlのアクチビン溶液で培養すると中胚葉を誘導できることが知られている8)。
アクチビン処理による中胚葉誘導は中期胞胚(stage8)で見られ、原口が出るstage10にはおこらなくなるとされている。そこで、Xhairy2の存在がアクチビンによる中胚葉誘導に対して影響を与えるかについて調べるために、4細胞期のツメガエル胚に、Xhairy2にEn2を結合させたXhairy2b-En mRNAを顕微注入し、胞胚期のアニマルキャップを切り出し、アクチビン処理を行なった。Xhairy2b-Enを顕微注入していないstage 8の胚のアニマルキャップはアクチビンに応答して伸長したが、Xhairy2b-En mRNAを顕微注入した胚のアニマルキャップは応答せず、伸長が阻害されているようにみえた。さらに発生が進んだstage10.5の胚でも同様の実験を行なったところ、コントロール胚、Xhairy2b-En mRNAを顕微注入した胚ともにアニマルキャップの伸長はみられなかった(図5)。この実験は本格的に研究を行なうための予備実験であったが、今回の結果から、神経堤領域のみならず予定外胚葉組織においてもXhairy2が未分化性を支配しているということを確認することができた。今後はXhairy2の持つ未分化能や細胞周期への関与をP27や細胞周期との関連に注目しながらより詳しく解析していく。
頭部形成におけるP2Y受容体の役割
脊椎動物は眼や耳・鼻などの感覚器官を持ち頭蓋骨によって脳が覆われ無脊椎動物とは区別される頭部構造を持つ。これは進化の過程で神経堤細胞やプラコードといった特殊な細胞集団を獲得したことによって複雑化してきたと考えられている9)。脊椎動物の頭部形成が行なわれる咽頭胚期の形態は種を超えて非常に類似しており、私たちは頭部形成機構を明らかにすることで脊椎動物の形作りにおける普遍的な理解へつながると期待している。
神経堤細胞やプラコードは様々な転写因子のカスケードによって制御されているが10)、それをサポートする細胞内環境を整えることも重要な条件と考えている。本研究では主にアフリカツメガエルを用い、脊椎動物において配列が高度に保存されているヌクレオチド受容体P2Yファミリーに注目した解析を行なった。P2Y受容体は7回膜貫通Gタンパク共益型の受容体で細胞外のヌクレオチドを受容し、細胞内環境を整え細胞増殖・分化・移動などを制御することが知られている11)。アフリカツメガエルのP2Y受容体は6つのサブタイプが確認されており、本研究ではその中でも特に保存性の高いP2Y1・P2Y4・P2Y11の3つのサブグループに注目した。
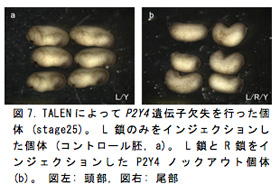
初期発生過程におけるこれらの遺伝子の発現パターンを調べると、神経堤やプラコード領域・頭部神経領域などの頭部構造に重要な領域に発現することが確認された。P2Y受容体と頭部構造の関連を調べるために、似た発現パターンを示したP2Y1とP2Y11に対してアンチセンスモルフォリノオリゴ (MO) を用いた機能阻害を行なうと、眼や脳に著しい形態異常が見られ、網膜マーカーやレンズマーカー・前脳・終脳・間脳マーカー・神経マーカーの発現低下が確認されており、これらの遺伝子と頭部形成における関与が示唆された。P2Y4に関しては、MOによる機能阻害実験では十分に遺伝子の機能を阻害することができなかったため、人工ヌクレアーゼ (TALEN) を用いた遺伝子欠失実験を試みており今年度はその影響の詳細な解析を行なった。
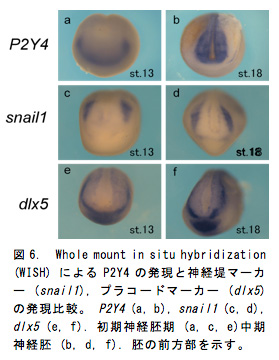
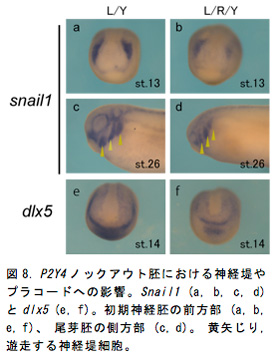
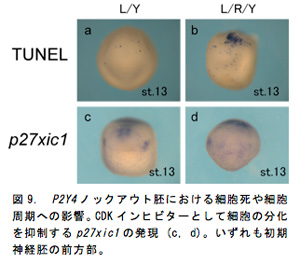
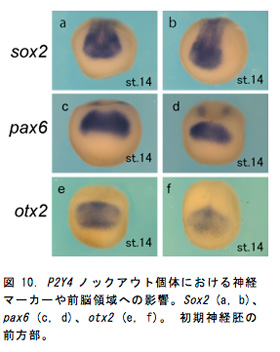
P2Y4の発現は神経胚期で頭部神経堤 (図6c, d) やプラコード領域 (図6e, f) に強い発現が確認されており頭部構造との関連が示唆された (図6a, b)。P2Y4ノックアウト胚は尾芽胚期までの生存率が約50%で、生存していた胚ではコントロール胚 (図7a) と比べて眼胞や耳胞が萎縮し頭部構造が全体的に縮小しており (図7b)、P2Y4が頭部形成過程において重要な役割を担っていることが示された。そこでP2Y4ノックアウト個体における神経堤マーカー (snail1) やプラコードマーカー (dlx5) の発現への影響を確認したところ、初期神経胚期でそれらの遺伝子の発現が著しく低下していた (図7a, b, e, f)。尾芽胚期になると正常胚では背側で生じた神経堤細胞は腹側へと向かって移動しているが (図3c黄矢じり)、ノックアウト個体では遊走する神経堤細胞は非常に少なく (図8d黄矢じり)、頭部構造全体でsnail1を発現している細胞が大幅に減少していた。これらの結果からP2Y4の機能破壊を行なうことによって、神経堤細胞やプラコードの維持が難しくなり結果的に頭部構造が萎縮していると考えられた。このような異常が生じた予定頭部領域においてTUNEL法によるアポトーシス検出を行なったところP2Y4ノックアウト個体ではアポトーシスのシグナルが増加しており (図9a, b)、P2Y4の機能を失うことで頭部領域の細胞の維持が難しくなることが示唆された。細胞内環境を調節するP2Y受容体の働きを失うことで神経堤細胞やプラコードなどの未分化性の維持に影響を与えることが考えられたため、細胞周期でG1 期へと移行させ細胞周期の進行を阻害するCDKインヒビターのp27xic1の発現を調べた (図9c, d)。その結果、ノックアウト胚ではコントロール胚に比べ前方部で発現が低下していることが確認された (図9d)。これはP2Y4の機能阻害を行なうことによってp27xic1を発現するはずの細胞が維持されなくなっているため発現領域が減少したと考えられる。これより、P2Y4が神経堤細胞やプラコードの維持のために細胞周期への直接的な関与がないことが示された。頭部萎縮が前方部で顕著に見られたため、さらに神経マーカー (sox2) や前脳領域のマーカー遺伝子 (otx2, pax6) の発現を調べるとコントロール胚 (図10a, c, e) に比べてノックアウト胚では前方部における発現領域の縮小や発現低下が見られた (図10b, d, f)。このように初期神経胚期で神経領域のマーカー遺伝子の発現に異常が出ていたことより神経領域が決定される時期に影響が出ることが予想され、頭部オーガナイザーとの関連も示唆された。
現在までのところ、P2Y4受容体は頭部が形成される初期の段階で重要な役割を持つことが明らかとなった。今後は、頭部領域が決定される時期も含め、この受容体がどのように神経堤細胞やプラコードに影響を及ぼし、頭部構造全体が形成されていくのかを明らかにしていきたいと考えている。
おわりに
両生類の新しいモデルの視点からあらためて原腸形成運動を眺めると、両生類の胚体形成が胚の表面で二次元的に行なわれているように見える。すなわち、胚の中心部分の細胞は卵黄を多く含む「栄養細胞」であり胚の構造形成に関与しない、トリや爬虫類の発生によく似た動きのように見える。
この比較を行なうと、すべての運動が同様に起こっているわけではなく、いくつかの「素過程」の連携によって成り立っていることが想定できる。オーガナイザー(あるいは脊索細胞)の移動、原口の形成、中胚葉(と内胚葉)の陥入、神経誘導、頭部形成、体節形成などが生物種によっては互いに時間的にオーバーラップし、あるいは独立にそれぞれの運動が進行し、結果として咽頭胚形成にいたるように見える。さらに、羊膜類胚では胚体の拡張も同時に起こる。
両生類モデルを基準にして羊膜類を見ると、素過程の並びかたの問題を越えた質的な違いに目が向く。たとえば鳥類の原条形成時に、コラーの鎌から頭部方向へと原条が形成されると教科書的には記載されているが、両生類モデルに合わせてみると原条は尾部方向へと伸長してもおかしくない。実際にニワトリ胚で確かめてみると、原則的には両生類の動きと同様の原条(原口)形成運動が見える。これは爬虫類(カメ)の原腸形成運動においても同様の観察がなされ、基本的には両生類モデルを踏襲している。また、哺乳類において脊索は頭部方向へと形成されるように見えるが、この動きに関しても異なる仮説が提出可能である。今後、哺乳類や鳥類(可能であれば爬虫類も)を用いて脊椎動物の咽頭胚を形成する機構について両生類モデルから統一的な説明が可能となると信じている。
参考文献
- 1)Yanagi, T., Ito, K., Nishihara, A., Minamino, R., Mori, S., Sumida, M., Hashimoto, C., 2015. The Spemann organizer meets the anterior-most neuroectoderm at the equator of early gastrulae in amphibian species. Dev. Growth, Differ. 57, 218-231
- 2)Spemann, H., Mangold, H., 1924. Über Induktion von Embryonalanlagen durch Implantation artfremder Organisatoren. Dev. Genes. Evol. 100, 599–638
- 3)Koide, T., Umesono, K., Hashimoto, C., 2002. When does the anterior endomesderm meet the anterior-most neuroectoderm during Xenopus gastrulation? Int. J. Dev. Biol. 46, 777–784
- 4)Vogt, W., 1929. Gestaltungsanalyse am Amphibienkeim mit örtlicher Vitalfärbung. II. Teil Gastrulation und Mesodermbildung bei Urodelen und Anuren. Wilhelm Roux Arch. Entwickl. Mech. Org. 120, 384–706
- 5)Sasai, Y., Lu, B., Steinbeisser, H., De Robertis, E. M., 1995. Regulation of neural induction by the Chd and Bmp-4 antagonistic patterning signals in Xenopus. Nature, 376, 333-336
- 6)Streit, A., 2004. Early development of the cranial sensory nervous system: from a common field to individual placodes. Dev. Biol. , 276, 1-15
- 7)Schlosser, G., 2005. Evolutionary origins of vertebrate placodes: insights from developmental studies and from comparisons with other deuterostomes. J. Exp. Zoolog. B. Mol. Dev. Evol. , 304, 347-399
- 8)Okabayashi, K., Asashima, M., 2006. In Vitro organogenesis using amphibian pluripotent cells. Proc. Jpn. Acad. Ser. B. Phys. Biol. Sci. , 82, 197-207
- 9)Gans, C., Northcutt, RG., 1983. Neural crest and the origin of vertebrates: a new head. Science, 220, 268-273
- 10)Sauka-Spengler, T., Bronner-Fraser, M., 2006. Development and evolution of the migratory neural crest: a gene regulatory perspective. Curr. Opin. Genet. Dev., 16, 360–366
- 11)Bogdanov, YD., Dale, L., King, BF., Whittock, N., Burnstock, G., 1997. Early expression of a novel nucleotide receptor in the neural plate of Xenopus embryos. J. Biol. Chem., 272, 12583-12590
