年度別活動報告
年度別活動報告書:2010年度
脊索動物と節足動物の共通祖先を理解する 2−2 カドヘリンの構造と機能の解析
小田広樹(主任研究員) 秋山-小田康子(奨励研究員)
野田彰子(研究補助員)
西口茂孝、金山真紀(大阪大学大学院生)
はじめに
多細胞動物は、細胞と細胞を連結する微細構造を持ち、その構造を巧みに操ることによって体の形を作り上げる。細胞間結合構造(ジャンクション)には何種類かのタイプが知られており、その中でアドヘレンスジャンクションは多細胞動物に最も普遍的に見られるジャンクションで、形態形成に最も密接に関わっていることが分かっている9)。アドヘレンスジャンクションの主要な接着分子はクラシックカドヘリン(以後、カドヘリンと呼ぶ)である。このカドヘリンは隣接した細胞に発現する同種のカドヘリンを認識し、結合する。このような細胞間隙で起こる同種カドヘリン間の結合は、細胞外カドヘリンドメイン(EC)と呼ばれる繰り返し構造を介して達成されているが、カドヘリンのECドメインの数や細胞外領域のドメイン構成には、左右相称動物の間で多様性がある。
これまでの比較解析では、その構造的多様性がヒトデやクモで共通に見られる状態からの独立的な短縮化で説明できることを見いだしている10)。短縮化されたひとつの状態である“昆虫型”は7個のECドメインを持ち、少なくともハエ、コオロギ、トビムシ、アルテミアで共通であり、それとは別の状態として、5個のECドメインを持つ“脊椎型”が脊椎動物とホヤで共通に存在する。ここで注目すべきは、脊椎型カドヘリンの5個のECドメインと昆虫型カドヘリンの7個のECドメインは異なる起源を持っていることである。細胞間接着の構造的仕組みは、これまで脊椎型のカドヘリンを使って詳細に解析されてきており、脊椎型のカドヘリンではアミノ末端側の2つのECドメインがホモフィリックな接着に主要な役割を果たしていることが知られている。そして、その2つのECドメインのうちアミノ末端側のECドメイン内の配列のわずかな違いが接着特異性を決めている。一方、ショウジョウバエのDEカドヘリンの解析では、このカドヘリンのアミノ末端側の6個のECドメインで強い接着活性が得られることが明らかになっている11)。しかし、ホモフィリックな接着に対して、その6個のECドメインがそれぞれどのような役割を果たしているかは全く不明である。本年度の研究では、カドヘリンの進化の過程で、構造を変えながらカドヘリンの接着能がどのように引き継がれてきたのか、また、接着特異性がどのように変更されてきたのかを探究する目的で、ショウジョウバエのDEカドヘリンとコオロギのGbEカドヘリンを用いてキメラ分子を作製し、接着特異性に関わる領域を特定することを試みた。
結果と考察
DEカドヘリンとGbEカドヘリンは異なる接着特異性を示す
ショウジョウバエのDEカドヘリンとコオロギのGbEカドヘリンは同じドメイン構成を示す昆虫型のカドヘリンである。ショウジョウバエの培養細胞であるS2細胞にショウジョウバエのDEカドヘリンとコオロギのGbEカドヘリンを別々に発現させ、それらの細胞を混ぜ合わせて集合実験を行った。その結果、その2種類の細胞は別々の集合塊を形成した。このことから、DEカドヘリンとGbEカドヘリンは異なる接着特異性を示すことが分かった。
DEカドヘリンとGbEカドヘリンのキメラ分子の作製と接着特異性に関する解析
DEカドヘリンとGbEカドヘリンの接着特異性がどのECドメインによって決定されているかを調べるために、DEカドヘリンとGbEカドヘリンのキメラ分子を様々な組み合わせで作製し、それらのキメラ分子を発現させた細胞と、そのままのDEカドヘリンまたはGbEカドヘリンを発現させた細胞とを混ぜ合わせて集合実験を行った。この集合実験で、キメラカドヘリンを発現する細胞がDEカドヘリンを発現する細胞と一緒に集合塊を作るのか、別々に集合塊を作るのか、逆に、GbEカドヘリンを発現する細胞と一緒に集合塊を作るのか、どうかを判定した。その結果、EC1-2がDEカドヘリン由来で残りの部分がGbEカドヘリン由来のキメラ分子の接着特異性はDEカドヘリンの接着特異性とは異なり、GbEカドヘリンと同じであることが分かった。昆虫型カドヘリンではEC3以降のECドメインが接着特異性を決めていることが示唆された。この状態は、アミノ末端のEC1ドメインで接着特異性を決めている脊椎動物のカドヘリンとは異なる。今後、さらに別のキメラ分子を作製し、解析することによって、EC3以降のどの領域が接着特異性に関わるかを特定したいと考えている。
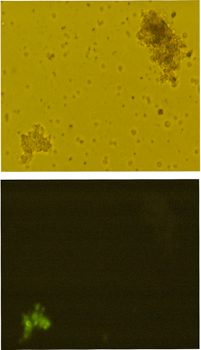
図5. キメラのカドヘリンを発現する細胞と本来のDEカドヘリンを発現する細胞を用いた集合実験
上のパネルは明視野像、下は蛍光像. キメラ分子には蛍光タンパク質が付加されている
おわりに
今年度の結果から、脊椎型のカドヘリンと昆虫型のカドヘリンではホモフィリックな接着のためにかなり異なる構造的仕組みを持っていることが推察された。カドヘリンによる細胞間接着は多細胞動物の細胞にとって普遍的な機能であるにもかかわらず、その構造的基盤は系統によって独自の進化を遂げている。本研究で行っているカドヘリンの構造と機能に基づく比較解析によって、動物進化の重要な部分が解明できるのではないかと期待している。
参考文献
1) Oda, H. and Akiyama-Oda, Y. (2008). Differing strategies for forming the arthropod body plan: lessons from Dpp, Sog and Delta in the fly Drosophila and spider Achaearanea. Dev Growth Differ 50, 203-214.
2) Akiyama-Oda, Y., Oda, H., 2010. Cell migration that orients the dorsoventral axis is coordinated with anteroposterior patterning mediated by Hedgehog signaling in the early spider embryo. Development 137, 1263-1273.
3) Nusslein-Volhard, C., Wieschaus, E., 1980. Mutations affecting segment number and polarity in Drosophila. Nature 287, 795-801.
4) Driever, W., Nusslein-Volhard, C., 1988. The bicoid protein determines position in the Drosophila embryo in a concentration-dependent manner. Cell 54, 95-104.
5) Roth, S., 2003. The origin of dorsoventral polarity in Drosophila. Philos. Trans. R Soc. Lond. B Biol. Sci. 358, 1317-29.
6) Stauber, M., Jackle, H., Schmidt-Ott, U., 1999. The anterior determinant bicoid of Drosophila is a derived Hox class 3 gene. Proc. Natl. Acad. Sci. U.S.A. 96, 3786-3789.
7) Kanayama, M., Akiyama-Oda, Y., Oda, H., 2010. Early embryonic development in the spider Achaearanea tepidariorum: microinjection verifies that cellularization is complete before the blastoderm stage. Arthropod Struct. Dev. 39, 436-445.
8) Akiyama-Oda, Y., Oda, H., 2006. Axis specification in the spider embryo: dpp is required for radial-to-axial symmetry transformation and sog for ventral patterning. Development 133, 2347-2357.
9) Gumbiner, B.M., 2005. Regulation of cadherin-mediated adhesion in morphogenesis. Nat. Rev. Mol. Cell Biol. 6, 622-634.
10) Oda, H., Tagawa, K., Akiyama-Oda, Y., 2005. Diversification of epithelial adherens junctions with independent reductive changes in cadherin form: identification of potential molecular synapomorphies among bilaterians. Evol. Dev. 7, 376-389.
11) Haruta, T., Warrior, R., Yonemura, S., Oda, H., 2010. The proximal half of the Drosophila E-cadherin extracellular region is dispensable for many cadherin-dependent events but required for ventral furrow formation. Genes Cells 15, 193-208.
