年度別活動報告
年度別活動報告書:2014年度
脊索動物と節足動物の共通祖先を理解する 2−1 オオヒメグモの胚発生を支配する分子メカニズムの解明
小田広樹(主任研究員) 秋山-小田康子(特別研究員)
佐々木瑞希(奨励研究員) 岩﨑佐和(奨励研究員)
野田彰子(研究補助員)
はじめに
多細胞動物は形態や発生様式に基づいて「門」と呼ばれる高次分類群(例えば、ヒトを含む脊索動物門や昆虫を含む節足動物門)に区分されているが、それぞれの分類群を特徴付ける形態が進化してきた過程やその進化の仕組みを理解することは簡単ではない。その大きな要因のひとつは、分類群を特徴づける、機能性の高い進化的に安定な形態であっても、その形態を形作るための発生過程やゲノム情報(遺伝子発現制御機構や遺伝子ネットワークなどを含む)は進化の過程で多様に変化しうることにある。
例えば、体の軸に沿った反復構造の存在は、ヒトなどの脊椎動物を含む脊索動物門と昆虫やクモを含む節足動物門に共通して見られる特徴であるが、その反復パターンを形作る遺伝的仕組みに両者が同一起源であることを示す確かな証拠は見出されていない。しかし、だからと言ってその類似の形態的特徴が異なる起源から別々に進化したと断言することはできない。なぜならば、共通祖先において存在した反復パターンを形成する仕組みが、発生プログラムのアウトプットとなる反復パターンを保持したまま、現存種のゲノムの比較では簡単に追跡できないほど大きな変化を経て多様化したかもしれないからである。このような可能性を考えた場合、形態で分類されるそれぞれの動物門での遺伝的仕組みの多様性の程度を大局的に把握することが動物門間の進化的関係を理解する上で重要であるが、形態進化とゲノム進化の基本原理を理解するという観点から言えば、特定の形態やパターンを発生プログラムのアウトプットとして出し続けながらそのプログラムがどのように進化し、多様化しうるかを、システム生物学や数理生物学を取り入れて解析することも重要となる。
私たちはこれまで、独自のモデル生物種として、節足動物門鋏角類オオヒメグモ (Parasteatoda tepidariorum) を用いて、節足動物の基本的体制(ボディープラン)に関わる発生メカニズムの多様性を明らかにしてきた。オオヒメグモ胚では、ヘッジホッグシグナルとディーピーピーシグナルを介した細胞間のコミュニケーションが直交した2つのからだの軸(前後軸と背腹軸)の形成に主要な役割を果たす1) 2)。とりわけ、ヘッジホッグシグナルの初期胚での重要な役割は、節足動物の進化において発生プログラムが大きく変化したことを象徴的に示す。オオヒメグモ初期胚で分泌タンパク質のヘッジホッグが果たす役割と同様の役割をショウジョウバエでは転写因子のビコイドが果たす3)。さらに、ヘッジホッグやビコイドの支配下で起こる縞パターン形成(体節形成)にもオオヒメグモとショウジョウバエで違いがある。つまり、発生プログラムのアウトプットとして縞パターンは両者で保存されているが、その縞パターンの形成過程は大きく異なる4)。クモを軸とした比較研究は、ボディープランの保守的進化の中で発生過程や発生メカニズムがどのように多様化したのか、また、どうして多様化できたのかを理解することに貢献しうる。これは、遺伝的発生システムの進化能の問題であり、理論研究とも連携すべき研究課題である5)。
本年度私たちは、個々の遺伝子の機能解析を中心としたクモ胚の研究を理論研究へと発展させたいと考え、多方面から準備を進めた。第一に、次世代シーケンサーを用いて、初期胚の遺伝子発現に関するゲノムワイドな定量データを取得するとともに、ヘッジホッグシグナルが関わる遺伝子ネットワークのダイナミクスを検出する試みを行った。第二に、クモ胚で起こっているパターン形成の現象を定量的に記述するためのデータを蓄積した。第三に、パターン形成過程をコンピュータによる再構成系で解析することを目指した多細胞体モデルの構築を進めた。第四に、ハエトリグモを使ってシグナル源の移植による重複胚の作出を行った。それぞれの試みは道半ばであるが、クモの特性を最大限活用した研究を展開したいと考えている。
結果と考察
(1)クモ初期胚でヘッジホッグシグナルに制御される遺伝子のゲノムワイドな探索
ヘッジホッグシグナルが制御する遺伝子の探索をゲノムレベルへと発展させた。ヘッジホッグシグナルは、多くの動物で様々な組織の極性形成に重要な働きをもつことが知られている。オオヒメグモ初期胚においては、胚全体の極性形成を支配していることを私たちはこれまでに明らかにしてきたが、この結果は動物の体軸形成に対してもヘッジホッグシグナルの役割に対しても新たな知見を提示しており、ゲノムワイドな探索によるクモ胚の極性形成・体軸形成に関わる遺伝子ネットワーク全貌の解明が、動物の体軸形成の進化やヘッジホッグシグナルの役割の進化に関する新たな理解につながると期待できる。
昨年度はヘッジホッグ遺伝子に対するparental RNA interference (pRNAi)とMiSeqを利用したRNA sequencing (RNA-seq)を組み合わせた解析方法の有効性をテストし、この方法がヘッジホッグpRNAiによる遺伝子発現変化を検出し得ることを確認した。本年度はこの方法をゲノムレベルの解析系へと展開させ、次のようなストラテジーを構築した。① pRNAiを行う前と行った後に産まれた胚からmRNAを抽出し、RNA-seqライブラリーを作製。② MiSeqを用いてRNA-seqを行い、各サンプル150 bp x 1000万リード程度の塩基配列情報を取得。③ ゲノム情報をリファレンスとしてBLATでマッピング。④ マッピングの結果をもとにCufflinksを用いてゲノム上に遺伝子領域と転写産物の構造を予測。⑤ HTseqにより各遺伝子あたりのマッピング数をカウントし、遺伝子発現量情報を取得。⑥ EdgeRを利用してpRNAiの前後で発現量に変動の見られる遺伝子を同定。⑦ クラスタリング解析やGene Ontology解析により発現が変動する遺伝子の特徴を抽出。⑧ UTGBのシステムを利用してオオヒメグモのゲノムブラウザを構築。遺伝子や転写産物の構造、遺伝子発現量を視覚的に示せるようにした(図1)。

オオヒメグモのゲノム配列は、Baylor College of Medicineのi5kプロジェクトにおいて解読された情報を利用した6)。オオヒメグモのゲノムサイズは約1.2 Gbで、多くの既知の昆虫のゲノムサイズの5倍以上である。また、ゲノムのアセンブルの状況は、Scaffold数が30,000超となっている。この大きさやアセンブル状況のために、マッピングや発現量カウントのアルゴリズムや、ゲノムブラウザなどで、試みたものの動かないものも多々あったが、遺伝研のスーパーコンピューターを利用するなどして、一通りの解析が行えるようになった。プレリミナリーな結果ではあるが、同定された遺伝子には、既知の遺伝子に加えて、FGFやWNTシグナル系の因子やショウジョウバエの背腹軸形成に関わる遺伝子などが含まれていた(図2)。
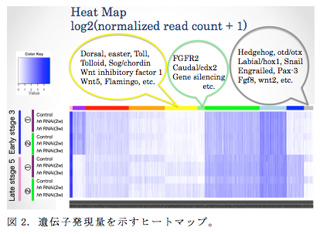
解析方法に関しては、マッピング後のフィルタリングや、遺伝子領域の予測などにまだ課題が残っている。ヘッジホッグシグナルの負の制御因子としてはたらくパッチトやスフのpRNAi胚を用いた解析も既に行っており、ヘッジホッグシグナルの抑制状態や活性化状態、正常な状態での遺伝子発現を、時間変化とともに、可視化する方法を考えたい。
(2)縞パターン形成過程の再構成:胚の形状指標Sの評価
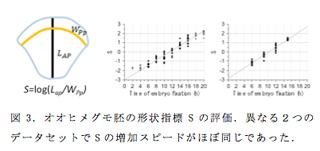
縞パターン形成は、実験生物学と理論生物学の両面からのアプローチが比較的容易な研究対象であるとともに、細胞、発生、進化の観点からメカニズムを探究できる奥行きの深い研究対象である。私たちは、オオヒメグモの胚発生においてヘッジホッグ遺伝子の発現パターンの変化として観察される縞パターン形成をひとつのモデルと考え、昨年度から縞パターン形成過程の再構成に取り組んできた。オオヒメグモでは生きた状態で遺伝子発現を直接観察する技術がないために、一定の時間間隔で固定した胚から得た遺伝子発現のデータを得て縞パターン形成過程を再構成する方法を検討してきた。しかし、同じタイムポイントで固定した胚グループの中にも発生の進行度合いにかなりのバラツキがあったため、私たちは胚の形状を反映した指標S=log(Lap/WPp) を定義し(Lapは胚領域の前後方向の長さ、WPpは将来の触肢体節に相当するヘッジホッグ発現縞に沿った背腹軸方向の長さ)、このS指標を基に発生時間を見積もった。昨年度取得したひとつのデータセットにおいて、胚を固定した時間とS指標の関係は傾き0.265±0.014 (1/時間)の直線で近似された。この傾きの値は胚の発生(変形)スピードを反映する値であるが、この値にどの程度の再現性があるのかを評価するために、本年度もうひとつのデータセットを取得し、その傾きを算出したところ0.280±0.013 (1/時間)で、ひとつめのデータセットとほとんど変わらない値であった。このことは、定義した指標Sがオオヒメグモの発生段階を表すひとつの客観的な数値指標となりうることを示唆した。
(3)胚盤の予定細胞運命地図の作製
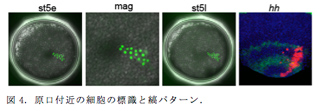
これまでのオオヒメグモ胚での遺伝子発現の解析から、胚盤から胚帯ができるまでの過程で様々な遺伝子の発現が波としての振る舞いを示すことが一部明らかになったが、胚盤内の位置によって細胞が胚帯のどの位置に貢献するのか、また、胚帯に表れる縞パターンとどのような位置関係にあるかについてこれまで断片的なデータしか得られていなかった。特に、胚盤の中心の原口とその周辺部の細胞が、胚帯の尾部領域に表れる様々な形の遺伝子発現パターンとどのような関係にあるのかは不明なままだった。本年度、NLS-tdEosFP mRNAのマイクロインジェクションによる細胞の標識と蛍光in situハイブリダイゼーション染色とを組み合わせた解析で、ステージ5初期の胚盤内の様々な位置の細胞を追跡して、ヘッジホッグの発現縞との位置関係を調べた。その結果、ステージ5初期の時点の胚盤の縁から3列目から5列目の細胞が頭部の3本のヘッジホッグ発現縞をカバーすることが分かった。ステージ5初期の段階では、ヘッジホッグの発現は胚盤の縁の一列目の細胞でしか見られないことと、そのヘッジホッグの縞状の遺伝子発現が継続的に観察されていることを考え合わせると、ヘッジホッグの発現波が最低でも4細胞分伝播していることが示唆された。
一方、胚盤の中心の原口部とその周辺の細胞は、内胚葉または中胚葉への貢献があるものの、多くが外胚葉として後体部の表面細胞層に残り、なかでも、原口閉鎖部の最近傍に位置した細胞は胚帯の後端領域に留まった(図4)。胚帯の後端領域ではヘッジホッグを始めとして、いくつかの遺伝子で小さいスポット型、大きいスポット型、ドーナツ型の発現パターンが観察されているが、今回の細胞標識実験の結果は、それらの発現パターンの違い(変化)が細胞の増殖や運動ではなく、遺伝子発現の振動で生じていることを強く示唆した。この遺伝子発現の振動現象を仮定した場合、前述の縞パターン形成過程の解析から、振動周期が5〜6時間程度と見積もられる。
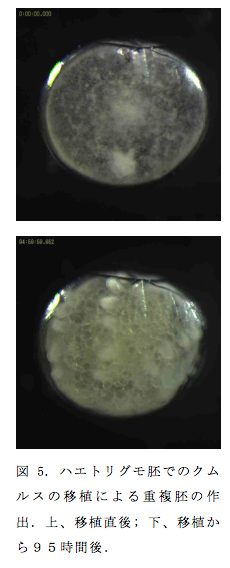
(4)ハエトリグモのクムルス移植実験による重複胚の作出
1952年のホルムの論文7)では、イナズマクサグモ胚を使ったクムルスの移植による重複胚の作出が報告されている。しかし、その論文以外にクモ胚での移植実験による重複胚の作出について報告がない。ところが最近、小田広樹がアドバイザーを務める愛知県立名古屋南高校の生物化学部が、ハエトリグモ(Hasarius adansoni)を使ってクムルスの移植による重複胚の作出に成功したと報告した。彼らの実験結果を確認するために、私たちの研究室でもハエトリグモを用いてクムルスの移植実験を行い、確かにこのクモ種で重複胚が誘導されることを確認した(図5)。ハエトリグモが高い調整能を持っていることが確認された。組織移植による重複胚の作出は脊椎動物ではよく行われてきたが、無脊椎動物ではあまり知られていない。身近なクモ種で重複胚を誘導する実験が可能になったことは、体軸形成の発生進化を研究するための新たな糸口になるかもしれない。
(5)多細胞体モデルの構築:細胞分裂の導入と球面座標への転換
昨年度の報告書で、javaプログラミングによる二次元の多細胞体モデルの構築について報告したが、本年度はそのモデルに2つの改良を加えた。ひとつめの改良は、細胞が分裂できる仕組みの導入である。細胞には一定の分裂周期を与え、乱数を使って細胞ごとにバラツキを持たせた。分裂面の位置を決めるには、細胞周縁上の互いに中間に位置する2点の組み合わせを探索して、その2点間の直線距離が最短となる組み合わせを選択した。細胞分裂に規則性が与えられていないことがこのアルゴリズムの特徴である。本研究では細胞間コミュニケーションと細胞運動の役割に重点を置いた再構成系の構築を目指す。
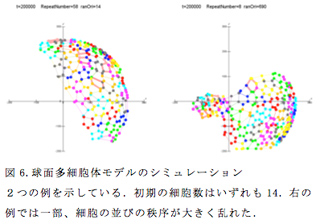
もうひとつの改良は、二次元平面から球面への座標の転換である。具体的には、各細胞の頂点の微小移動を球面上で行うようにした。この変更以外、アルゴリズムを特に大きく変更することなく、二次元平面と同じように球面上で細胞の分裂と再配列が可能となった(図6)。しかし、細胞の辺が交差したり、凝集したりして細胞の秩序的な並びが維持できないようなケースが頻繁に生じた(図6 右)。この問題を克服するには、秩序の乱れが小さいうちに修復する仕組みや組織の伸展を促進する仕組みの考案が必要かもしれない。今後は、遺伝子ネットワークと細胞間のコミュニケーションの導入を行いたい。
おわりに
ヘッジホッグが支配するパターン形成過程を初期段階からゲノムワイドに解析できる系はクモ初期胚の他に存在しない。RNA-seq解析はゲノム解析技術を独自に学習しながら進めてきたが、その中で、その解析技術のパワーを実感してきた。技術の限界までこだわることで新しい発見ができるのではないかと期待している。しかしながら、現在行っている胚まるごとの解析では時間情報を取れても、空間情報を得ることはできていない。パターン形成の研究としては致命的である。今後は、領域ごと、または細胞ごとの解析ができるような技術的アプローチを模索する必要がある。また、ハエトリグモの移植実験からも分かるように、クモ胚の最大の特徴は調整能である。私たちが解析を進めているヘッジホッグシグナルがその調整能を支える分子メカニズムの一部となっている可能性は十分にある.クモの価値を発生の調整能を分子、細胞レベルで研究できるモデルとして捉え、実験と理論の両面から研究を展開していきたい。
