年度別活動報告
年度別活動報告書:2015年度
脊索動物と節足動物の共通祖先を理解する 2−2 カドヘリンの構造と機能の解析
小田広樹(主任研究員) 秋山-小田康子(特別研究員)
岩﨑佐和(奨励研究員) 野田彰子(研究補助員)
はじめに
多細胞動物は、細胞と細胞を連結する微細構造(ジャンクションと呼ぶ)を持ち、ジャンクションを巧みに操ることによって体の形を作り上げる。ジャンクションには微細形態と機能によって何種類かのタイプが知られており、その中でもアドヘレンスジャンクションは、多細胞動物で最も広い系統分布を示すジャンクションで、形態形成に最も密接に関わっていることが知られている9,10)。アドヘレンスジャンクションの主要な接着分子はクラシカルカドヘリン(以後、カドヘリンと呼ぶ)である。このカドヘリンは隣接した細胞に発現する同種のカドヘリンを認識し、結合する。上皮組織では、各細胞内で作用する張力がカドヘリンの細胞外領域での分子間結合を介して隣接細胞に伝達されるが、この力学的相互作用が上皮組織の形態形成運動を引き起こす主要因の一つとなっている11, 12)。
細胞間で起こるこの同種カドヘリン間の結合は、細胞外カドヘリンドメイン(EC)と呼ばれる繰り返し構造を介して行われる。ところが、興味深いことに、形態形成運動に必要な力が作用するカドヘリン細胞外領域におけるECドメインの数やドメイン構成には、多細胞動物の系統間で多様性がある13)。例えば、昆虫類および鰓脚類は、7個のECを持ち上皮組織に局在するA1型カドヘリンと、17個のECを持ち神経組織に局在するA2型カドヘリンを持つ。ウニのカドヘリンは17個のEC、脊椎動物とホヤのカドヘリンは5個のECを持つ。カドヘリンの構造はどのように多様化してきたのか? その多様化の際、カドヘリンの機能や接着のメカニズムは変化したのか? さらに、そのようなジャンクションにおける変化は形態の進化に影響を与えなかったのか? 本研究では、これらの疑問に対する答えを探究している。
5個のECを持つ脊椎動物のタイプIカドヘリンについては、結晶X線解析や核磁気共鳴法、電子顕微鏡により細胞外領域の構造が詳しく研究されてきた14),15),16),17)。それらの研究によると、その連続する5個のECは少しカーブした棒状の構造をとっており、その先端のEC1が細胞外領域のホモ結合において主要な役割を果たすことが示されている。EC1の2番目のアミノ酸のトリプトファンは脊椎動物のカドヘリンの間で非常によく保存されており、このトリプトファンの側鎖が相対するカドヘリン分子のEC1にある疎水性のポケット構造に挿入されて、脊椎動物のカドヘリンのホモ結合が成立する。しかし、六脚類のカドヘリンには対応するトリプトファンは存在しないために、六脚類に脊椎動物のカドヘリンの仕組みを適応することはできない。一方、私たちこれまでの研究で、ショウジョウバエの上皮カドヘリン(DEカドヘリン)のN末側6個のECが細胞間の接着を仲介できる機能単位を構成していることを明らかにした18)。しかしながら、その構造的仕組みを理解するに至っていない。
そこで昨年度、私たちはオリンパスの協力を得て、DEカドヘリンの細胞外領域の分子形態を原子間力顕微鏡で観察する試みを始めた。この観察技術は探針を走査することにより細胞の表面や分子の表面の凹凸を直接観察する技術である19)。この技術の利点は、タンパク質の結晶化を必要とせず、タンパク質が少量であっても穏やかな条件下で精製できれば、特別な処理をすることなくそのままの状態で直接観察することができる点である。高分子タンパク質の全体的な構造を観ることができる点も利点である。
本年度、DEカドヘリンの原子間力顕微鏡による観察を続け、分子の形が見えてきたので報告する。さらに、観察された分子形態の機能的意義を探究する目的で、2011年度に報告したキメラカドヘリン分子の解析を発展させて研究を進めた。
結果と考察
(1)ショウジョウバエEカドヘリンの細胞外ドメインの原子間力顕微鏡による観察
昨年度作製した、ショウジョウバエのDEカドヘリンの細胞外領域のN末側6個または4個のECをもつ計3つの発現コンストラクト(DEEC6-His, DEEC6-GFP-His, DEEC4-His)をもとに、タンパクを精製し、原子間力顕微鏡(ナノダイナミクス観察システムBIXAM, オリンパス㈱)での分子形態の観察を行った(図5)。DEEC6-Hisは大多数の分子がオタマジャクシ形をしており、"頭部(H)"と"尾部(T)"に分けられた。C末側のEC6がどの部分にあるのかを調べるために、C末にGFPタグの付いたDEEC6-GFP-Hisを観察したところ、DEEC6-Hisと同じようにオタマジャクシ形の形態が見られたが、尾部側の端にGFP部分と考えられる球状の構造が付加していたことから(図5、矢印)、EC6はDEEC6-Hisの尾部内の末端側に位置することが示唆された。さらに、DEEC6-Hisの高解像度での観察では尾部に形態的なくびれが観察され、尾部が2つのECで構成されていることが示唆された。また、DEEC6-Hisの頭部を右側から見た分子サンプルではECのストランドがJ形に折れ曲がっている様子が観察され、EC1-EC4が折れ曲がって頭部の球状構造が形成されていることが考えられた。このことを確認するためにDEEC4-Hisを観察したところ、期待に反して、様々な形態を示す分子が観察された。しかしよく見ると、ほとんどのDEEC4-His分子で分子長の端から3分の1あたりに"首"のように見える形態的なくびれが存在し、その部分で分子は様々な角度に折れ曲がっていた。この結果はDEカドヘリンのEC1-EC4領域が折れ曲がり構造を取りうることを示すだけでなく、その領域が安定した球状の構造を取るためにはEC5-EC6領域の全体もしくは部分が必要であることを示唆した。
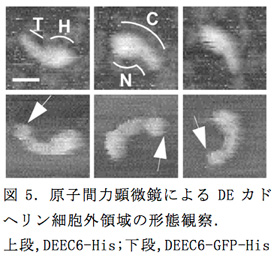
隣り合うECが結合する領域はカルシウムイオン3分子の挿入によってECのタンデムな構造が強固になることが知られているが、DEカドヘリンのEC2とEC3の結合領域はカルシウム結合モチーフを欠いており、折れ曲がった構造を取りうることが他のカドヘリン分子の構造解析から類推される。EC1-EC4領域の球状構造はECストランドのこの部分での屈曲で形成されている可能性が高い。
(2)六脚類Eカドヘリンのホモ結合特異性を担う領域の同定
2011年度の報告書で示したように私たちはこれまでに、ショウジョウバエのDEカドヘリンとコオロギのGb1カドヘリンが異なる接着特異性を示し、さらに、それらのキメラ分子を作製し、解析することによって、EC1-EC4領域にホモ結合の特異性を決める因子が存在することを示唆するデータを得ていた。本年度、原子間力顕微鏡で観察されたDEカドヘリンの分子形態の機能的意義を明らかにする目的で、このキメラ分子の解析を発展させた。具体的には、さらに異なるキメラ分子を作製し、それぞれについてDEカドヘリン、Gb1カドヘリン、DNカドヘリン(ネガティブコントロール)に対する選好性を細胞共集合アッセイによって定量化した(図6)。その結果、結合特異性を決める要因として、EC1の重要性に加えて、EC3, EC4の重要性が示唆された。作製した多くのキメラ分子の中で、D1G23とD1G234は注目すべき性質を示した。D1G23はDEカドヘリンとGb1カドヘリンのどちらに対しても選好性を示すが、形成された細胞集合塊の中の細胞の混ざり方を見ると、D1G23を発現する細胞同士が優先的に小さな塊を作っていることが分かった。つまり、D1G23はDEカドヘリンやGb1カドヘリンよりもD1G23自身により強い選好性があることが考えられた。この傾向はD1G234ではより顕著に表れ、D1G234を発現する細胞はそれら自身で集合塊を作ったものの、DEカドヘリンやGb1カドヘリンが作る細胞集合塊にはほとんど取り込まれなかった。この結果から、EC2-EC4領域がホモ結合を担う中枢部分である可能性が示唆されたため、この可能性をさらに検討するために、DEカドヘリンのEC2-EC4をトビムシのオルソログFc1カドヘリンのEC2-EC4と取り替えたキメラ分子(D1F234と命名)を作製し、DEカドヘリン、D1G234、D1F234をそれぞれ発現する細胞を用いて共集合アッセイを行ったところ、それぞれが別々の集合塊を作った。DEカドヘリン、D1G234、D1F234の構造上の違いはEC2-EC4領域だけなので、この領域にホモ結合の特異性を決定する主要因が含まれることが示唆された。また、D1G23がそれ自身と同じ構造の分子に対して高い選好性を示すことが同じ種のEC間の(進化的に)最適化された相互作用によって生じると仮定すると、細胞間で向き合うカドヘリン分子のEC2-EC4領域が互いに平行に配置していると考える方が、逆平行に配置していると考えるよりも考えやすい。さらに、向き合うEC2-EC3領域がこのような配置をとった場合、原子間力顕微鏡で観察されたようにEC1-EC4領域が折れ曲がった配列をしていると、EC1のホモ結合への参加も容易になると推察される。これらの推測事項は今後の研究で検証される必要がある。
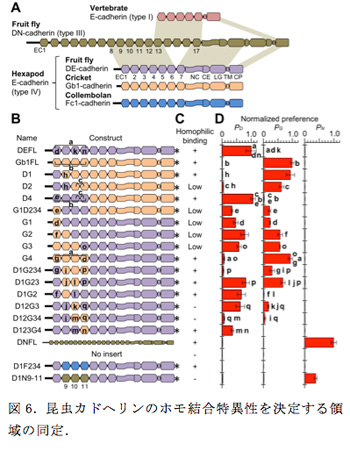
六脚類Eカドヘリンのホモ結合の特異性の決定においてEC2-EC4領域の重要性が示されたが、祖先的ドメイン構成をもつショウジョウバエDNカドヘリンの対応する連続した3つのECにも自身と同じカドヘリン(つまり、DNカドヘリン)に対して結合特異性を示す能力があることが確認された。このことは、六脚類のEカドヘリンとNカドヘリンはECの数が大きく異なるが、ホモ結合のための仕組みを少なくとも部分的に共有していることを示唆した。
おわりに
脊椎動物のEカドヘリンの対応分子として、DEカドヘリンはショウジョウバエの卓越した遺伝学を用いて様々な現象における機能がよく研究されてきたが、細胞間接着の要であるEカドヘリンのホモ結合の構造的基盤には脊椎動物と六脚類ではっきりとした違いがあることが本年度の研究で明らかになった。この違いが機能的差異を生じない単なる構造のみの違いなのか、それとも接着構造の物理的、機械的性質に影響を及ぼしている違いなのか、動物の形態進化を理解する上で重要な問題がそこにある。接着構造を通して形態形成に関わる力の伝達がなされていると考えるならば、例えば、接着構造の硬性や伸縮性、流動性などの性質が形態形成メカニズムの進化に影響を与えたかもしれない。このような方向から動物の形態進化を理解しようとした場合、六脚類のEカドヘリンの元となったカドヘリンの構造基盤を明らかにすることは重要である。
謝辞
原子間力顕微鏡によるDEカドヘリンの分子形態の観察はオリンパス株式会社の西口茂孝氏、八木明氏、酒井信明氏の協力を得て行った。
参考文献
- 1)Akiyama-Oda Y., Oda H. (2006) Axis specification in the spider embryo: dpp is required for radial-to-axial symmetry transformation and sog for ventral patterning. Development.133, 2347-2357.
- 2)Akiyama-Oda Y., Oda H. (2010) Cell migration that orients the dorsoventral axis is coordinated with anteroposterior patterning mediated by Hedgehog signaling in the early spider embryo. Development.137, 1263-1273.
- 3)Driever W., Nüsslein-Volhard C. (1988) The bicoid protein determines position in the Drosophila embryo in a concentration-dependent manner. Cell.54, 95-104.
- 4)Kanayama M., Akiyama-Oda Y., Nishimura O., Tarui H., et al. (2011) Travelling and splitting of a wave of hedgehog expression involved in spider-head segmentation. Nat. Commun.2, 500.
- 5)Fujimoto K., Ishihara S., Kaneko K. (2008) Network evolution of body plans. PloS. One. 3, e2772.
- 6)Richards S. (2015) Human Genome Sequence Center Baylor College of Medicine,
https://www.hgsc.bcm.edu/arthropods/common-house-spider-genome-project - 7)Common House Spider Genome Project, 代表:McGregor, A.
- 8)Holm, (1952) Experimentelle Untersuchungen über die Entwicklung und Entwicklungsphysiologie des Spinnenembryos Zool. BiDr. Uppsala.29, 293-424.
- 9)Harris T.J.C., Tepass U. (2010) Adherens junctions: from molecules to morphogenesis. Nat. Rev. Mol. Cell. Biol.11, 502-514.
- 10)Oda H., Takeichi M. (2011) Evolution: Structural and functional diversity of cadherin at the adherens junction. J. Cell. Biol.193, 1137-1146.
- 11)Rauzi M., Verant P., Lecuit T., Lenne P.-F.F. (2008) Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis. Nat. Cell. Biol.10, 1401-1410.
- 12)Landsberg K.P., Farhadifar R., Ranft J., Umetsu D., et al. (2009) Increased cell bond tension governs cell sorting at the Drosophila anteroposterior compartment boundary. Curr. Biol.19, 1950-1955.
- 13)Oda H., Tagawa K., Akiyama-Oda Y. (2005) Diversification of epithelial adherens junctions with independent reductive changes in cadherin form: identification of potential molecular synapomorphies among bilaterians. Evol. Dev.7, 376-389.
- 14)Pokutta S., Herrenknecht K., Kemler R., Engel J. (1994) Conformational changes of the recombinant extracellular domain of E-cadherin upon calcium binding. Eur. J. Biochem. 223, 1019-1026.
- 15)Shapiro L., Fannon A.M., Kwong P.D., Thompson A., et al. (1995) Structural basis of cell-cell adhesion by cadherins. Nature.374, 327-337.
- 16)Overduin M., Harvey T.S., Bagby S., Tong K.I., et al. (1995) Solution structure of the epithelial cadherin domain responsible for selective cell adhesion. Science.267, 386-389.
- 17)Boggon T.J., Murray J., Chappuis-Flament S., Wong E., et al. (2002) C-cadherin ectodomain structure and implications for cell adhesion mechanisms. Science.296, 1308-1313.
- 18)Haruta T., Warrior R., Yonemura S., Oda H. (2010) The proximal half of the Drosophila E-cadherin extracellular region is dispensable for many cadherin-dependent events but required for ventral furrow formation. Genes. Cells.15, 193-208.
- 19)Suzuki Y., Sakai N., Yoshida A., Uekusa Y., et al. (2013) High-speed atomic force microscopy combined with inverted optical microscopy for studying cellular events. Sci. Rep.3, 2131.
