年度別活動報告
年度別活動報告書:2001年度
アゲハチョウ類の寄主認識に関与する化学受容機構と食性進化の解明
吉川 寛(常勤顧問)
小野 肇(奨励研究員)
尾崎克久(奨励研究員)
はじめに
多くの動物にとって味覚による化学物質の認識は生存のために非常に重要である。特に昆虫は寄主選択、配偶行動、集団生活の維持など様々な場面において化学物質を巧みに利用している。昆虫と環境との関わり、その結果として生じる多様化、種分化、進化の謎を解くために、味覚は有力な指標になると考えられる。
アゲハチョウは単食性に近い狭い食草選択をしており、食草選択とアゲハチョウ科の進化とに相関関係が認められる。このことに注目して、選択の仕組みを明らかにする研究が行われ、食草に含まれる化合物の一定の組み合わせによって雌成虫に産卵行動を誘発することが明らかになった。その際、チョウは前脚ふ節に存在する感覚毛によって化合物を識別すること、感覚毛には典型的な味覚細胞が存在することが分かっている(図1)。このことから、味覚細胞には産卵刺激物質特異的な味覚レセプターが発現していることが予測される。
最も良く研究されているナミアゲハ(Papilio xuthus)では、ウンシュウミカンの葉から産卵刺激物質として10種類の化合物(図2)が単離されている1)。それらは、主としてフラボノイド、アミン類、糖の誘導体に分類される。面白いことに化合物単独では産卵刺激活性を示さないが、複数の組み合わせによって、様々な活性を示す。ほかにも数種のアゲハ類で産卵刺激物質が明らかにされており、アゲハチョウの系統と産卵刺激物質の構造を比較すると、アゲハ類は特定の系統の化合物群を寄主認識の手がかりとしながら食性の幅を広げたと考えられる。このことから、アゲハチョウにおいて、前脚ふ節に存在する味覚のレセプターは種ごとに特徴的な多様なレパートリーを持っていることが予想され、それらを網羅的に解析すれば、レセプター進化と食性の変化の関係を解き、種分化の謎に迫れると考えた。
昆虫の味覚レセプターの研究はその構造の多様さのため遅れていたが、2000年になって初めてショウジョウバエから候補遺伝子が同定された。まず、ショウジョウバエ全ゲノム配列情報から、新規の7回膜貫通Gタンパク質共役型レセプター(以下GPCRと略)ファミリーが発見され、発現場所が味覚器官に局在することから味覚レセプターと推定された2)。一方突然変異体を利用した遺伝学的研究によりロドプシンファミリーに属するGPCRのトレハロースレセプター(Tre1)が報告された3)。これらの研究が引き金となって、ショウジョウバエの味覚研究が急速に進展している。
味覚レセプターは多様性が著しく、ショウジョウバエの遺伝子情報をアゲハ味覚レセプターのクローニングに直接利用することは出来ないが、これらの研究、特に情報科学的な知識を利用してアゲハチョウの産卵刺激物質のレセプターを同定することを試みた。そこで、まず産卵刺激物質の全容が明らかにされているナミアゲハを材料に前脚ふ節に発現する味覚レセプター遺伝子のクローニングを目的に現在研究に取り組んでいる。それと併せて種々の研究において、味覚レセプターの比較対象となるレファレンス遺伝子をアゲハからクローニングした。これらの研究経過について報告する。なお、将来的には各種アゲハ間でのレセプター構造の共通性と多様性を解析し、分子レベルでアゲハチョウの食草選択の進化を解き明かしていきたいと考えている。
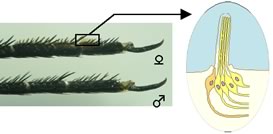
【図1】アゲハ前脚ふ節の感覚毛
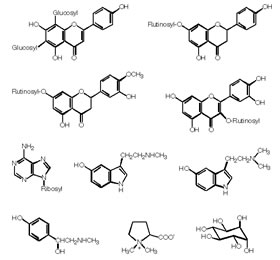 |
【図2】ミカンに含まれるアゲハの産卵刺激物質
アゲハの飼育
産卵刺激物質に対するレセプターがアゲハ前脚のふ節に局在することは、未知遺伝子のクローニングを行うために有利なことであるが、ふ節あたり数百個の味覚細胞と、味覚レセプターの発現の低さを考えると少なくとも数百匹単位の大量飼育が必要である。 我々は成虫を野外で採集し、ミカンの葉を供与して、24℃、日長16時間の周期で累代飼育を行った。途中、病気感染がおこり数百匹の幼虫が死滅してしまったが、紫外線やホルマリンで飼育容器を消毒することにより解決出来た。最終的に、この一年間でおよそ500匹のアゲハを得ることができ、種々の実験に用いた。
なお、ミカンの葉は大阪府立園芸高等学校の御厚意によるものであり、この場を借りて感謝したい。
cDNAの調製
カミソリを用いてアゲハふ節から感覚毛が密集した部分を切除した。収集した試料からtotal RNAを抽出し、クロンテック社のSMART PCR cDNA Synthesis KitによりcDNAを調製した(図3)。SMART法は、MMLV逆転写酵素が追加するd C配列を利用し、末端にアダプター配列を結合する技術である。両末端のアダプター配列に結合するプライマーを用い、PCRにより全長cDNAを増幅した。得られたPCR産物からライブラリー調製および遺伝子クローニングを行った。
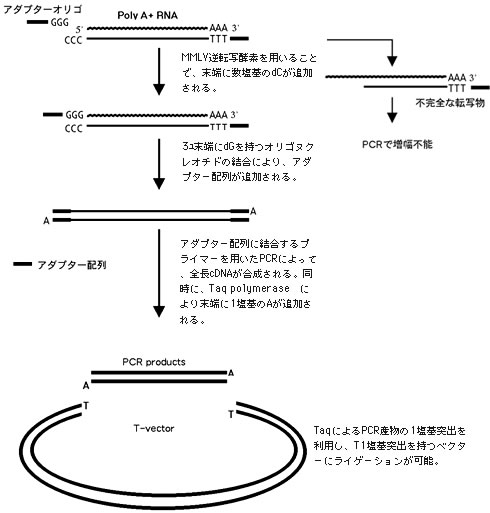 |
【図3】SMART法とTAクローニングの原理。
cDNAライブラリーの構築
過去の報告から、味覚受容に関わるGPCRの発現量は、非常に少ないことが予想される。そのため、cDNAライブラリーの構築は、できる限り少ない処理過程で行うことが望ましいと思われる。本研究では、cDNA調製にPCRを用いていることから、増幅産物の両末端にTaq polymeraseによるアデニン1塩基の突出が追加されていることを利用し、TAクローニングを試みた(図3)。PCRによって合成したcDNAを精製し、1塩基のチミン突出末端を持つプラスミドベクターとライゲーション反応を行い、ヒートショックによる形質転換を行った結果、ベクター1オgあたり2×106 cfu、Blue:White比 4:6の形質転換効率が得られた。コロニーPCRによってインサートサイズを確認した結果、1Kbpを超えるサンプルが約25%観察された(図4)。ショウジョウバエ味覚レセプターのmRNAは1.6Kbp程度であることが報告されている4)ので、非翻訳領域は2-300bpと予測される。従って、インサートを両端から、600bp程度配列決定すればよいと考えた。
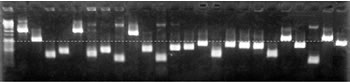 |
【図4】コロニーPCRの泳動結果。
25%のサンプルのインサートが1Kbを越えている。
点線は1 Kbpを示す。
EST解析
塩基配列の決定には、コロニーPCR産物をテンプレートとするダイレクトシークエンス法を用いた。通常では、PCR産物を精製してからサイクルシークエンス反応のテンプレートとして用いるが、1万クローンを目標としてEST解析を行うため、シークエンス作業の省力化について検討した。未精製のコロニーPCR産物をそのままテンプレートとしてサイクルシークエンス反応に用いた場合、塩基配列は読めるもののシグナルの減衰が早く、配列を決定できる領域が短くなる傾向が観察された。未精製PCR産物を超純水で1/10希釈して用いた場合には、同様のシグナルの減衰が起こりにくいことが確認された。サイクルシークエンス反応後の精製については、反応を終えた96穴プレートにエタノールを加え、2000回転で5分間遠心し、遠心後に96穴プレートを逆さにして3秒程度遠心し上清を除去することで、未反応物を十分に除去できることを確認した。以上の簡便法により、プラスミドを調整した場合で2日、PCR産物を精製した場合で3時間必要であったテンプレート調製が5分に、3時間必要であったシークエンス反応物の精製が15分に短縮された。
約600bpの配列を決定し、BLASTを用いてホモロジー検索を行った。データベースにホモロジーの高い遺伝子が見つかった場合を「known」、膜タンパクとホモロジーを示した場合を「membrane」、ホモロジーの高い遺伝子を特定できなかった場合を「unknown」、その他「ribosomal protein」、「rRNA」の5つのカテゴリーに分類した結果、192サンプル中knownが26.0%、membraneが1.0%、unknownが56.8%、ribosomal proteinが6.3%、rRNAが9.9%であった(図5)。unknownが最も多くなった理由として、ベクターに結合するプライマーを用いてインサート末端から配列を決定しているため、決定できた領域がアミノ酸コード領域に到達していない可能性も考えられる。ホモロジーの高い遺伝子を特定できたサンプルは52あり、33遺伝子が見つかった(図6)。重複が観察されたのは33遺伝子中8遺伝子で、25遺伝子は独立クローンであった。最も多く重複していたのは、昆虫の表皮を構成するタンパクであるcuticle proteinで8クローンであった。unknownに分類されたサンプルの中で、最も多くの重複が観察されたものは3クローンであった。ホモロジー検索により膜タンパク・BHKp23が検出されたが、膜貫通領域は2ヶ所であり、GPCRではなかった。味覚や嗅覚といった感覚受容のレセプターは非常に多様性が高いことが知られており、配列のホモロジーによる探索は難しいことが予想される。
そのため、タンパク質の構造を推定しGPCRの候補遺伝子を検出するアルゴリズムである、Quasi-periodic Feature Classifier ( QFC)5)による解析ソフトを構築(コンパイル)し、GPCRの検索を試みた。QFCのC言語によるプログラムは作者のWWWページ(http://jkim.eeb.yale.edu/)より入手可能であるが、ソフトウエアとして動作可能な状態に構築するには数ヶ所の書き換えが必要であった(国立遺伝学研究所遠藤氏の協力を得たことを感謝する)。このソフトを用いて、ショウジョウバエのトレハロースレセプターとして報告されているtre1とGr5aについえ検索を行った結果、どちらもGPCRとして検出された。また、連続した50アミノ酸を無作為に抜きだした配列データを用いた場合でも、高感度に検出されることを確認した。収集したESTライブラリーを解析し、GPCRの部分的な情報を得ることができれば、味覚受容体の候補を絞り込むことが可能であると考えられる。ホモロジー検索でunknownに分類されたサンプルを用いて QFCによる検索を行った結果、GPCRの候補として検出されたサンプルは見つかっていない 。
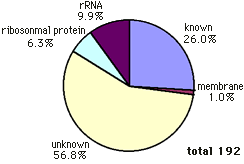 |
【図5】ESTの分類と割合。
ホモロジーの不明なサンプルがもっとも多かった。
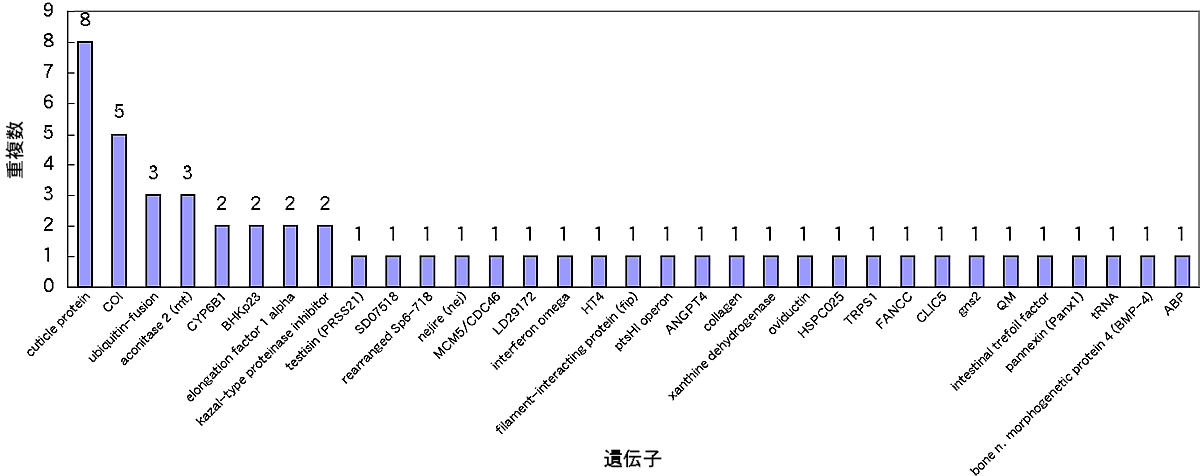 |
| 【図6】検出された遺伝子と重複数 |
アゲハの遺伝子のクローニングおよび解析
i) 時計遺伝子periodのクローニング
神経細胞での発現が予想されるGPCR探索の対照とするために、同じく神経細胞で発現している生物時計遺伝子periodのクローニングを行った。他の鱗翅目昆虫の配列情報を参考にdegenerate primerを設計し、アゲハ頭部のcDNAをテンプレートとするPCRによって得られた増幅断片の解析により、168塩基の配列を決定した。次に、この部分に特異的に結合するプライマーを設計し、RACE法により未知領域を含む増幅断片が得られた。この増幅断片の解析により、約3600塩基と予想されるperiod遺伝子の1861塩基の配列を決定した。得られた配列情報をもとに、実験の目的に応じた様々なプローブの設計が可能になった。actinが増えにくい傾向があったふ節組織のcDNAでも、periodは良好な増幅結果を示した。以上の結果から、対照実験のために有用なクローンが得られたと考えられる。
ii) アミンレセプターのクローニング
アゲハ類の産卵刺激物質のうちアミン類に着目してみるとその多くは神経伝達物質およびその類縁体である。例えば、トリプタミン類縁体やフェネチルアミン類縁体が2種類ずつ報告されている。一方、ショウジョウバエおよびカイコなどの鱗翅目昆虫から神経伝達物質として作用するセロトニンおよびオクタパミンのレセプターがGPCRとしてクローニングされている。これより、産卵刺激物質のレセプターの中でも、アミン類に対するレセプターは神経伝達に働くレセプターと共通性を持っているかも知れない。このような可能性を検討する目的で、アゲハにおいて発現する神経伝達物質(アミン)レセプターのクローニングを試みた。
神経伝達物質として作用するアミン類のレセプターは膜貫通領域で種を超えてアミノ酸の保存性が高い。この領域からdegenerate primerを設計してPCRによりアゲハ頭部から調製したcDNAよりアミンレセプターの増幅を試みた。その結果、セロトニンおよびオクタパミンのレセプターの遺伝子を増幅し、塩基配列を決定した。鱗翅目昆虫のセロトニンレセプターはHeliothis virescensとカイコについて、オクタパミンレセプターはH. virescens、カイコ、ヨトウガについて決定されている6)。今回アゲハから決定したセロトニンレセプターのアミノ酸部分配列はH. virescensと92.9%の高い相同性を示した。一方、カイコとは41.1%の相同性であった。オクタパミンレセプターのアミノ酸部分配列については3種の鱗翅目昆虫全てと75.3-75.8%の高い相同性を示した。
今回、ふ節から目的遺伝子を増幅することは出来なかった。頭部で発現するアミンレセプターの配列を決定したので、今後、この配列を利用してふ節での発現について検討する。
iii)G-proteinのクローニング
本研究でクローニングを目指している味覚レセプターは、三量体G-proteinと呼ばれるタンパク質群と共役して機能を果たす。哺乳動物の場合では、苦味物質と甘味物質でG-protein以下のシグナル伝達経路が異なる。前者では、ホスホリパーゼ Cを介しIP3(イノシト-ル3リン酸)が、後者では、アデニル酸シクラーゼを介しcAMPが、それぞれセカンドメッセンジャーとして伝達に関わる。一方、昆虫ではこのようなシグナル伝達経路の詳細が未だ明らかになっていない。今後の機能解析を目的として、アゲハからG-proteinのクローニングを試みた。
他の生物種の既知のG-proteinの配列情報をもとにプライマーを設計し、アゲハから抽出したcDNAを用いクローニングを行ったところ、1,065塩基から成る全長のDNAが得られた。相同性検索の結果、この配列は、Go-proteinのαサブユニット(Goα)と非常に高い相同性を持つことがわかった7)。Goαは、ホスホリパーゼ Cと結合して、神経細胞で興奮伝達などに関わるG-proteinとして知られている。
ここで一つ興味深いことがわかった。前脚ふ節と頭部から調製したcDNAからクローニングした二つのGoαの塩基配列を比較したところ、N端約90塩基の領域のみにおいて5個のアミノ酸が両者で異なっていた。既知のG-proteinのX線結晶構造から、この領域はレセプター、あるいはシグナルを下流に伝達する酵素との結合部位に近いことがわかった。即ち、両者のGoαが、異なるレセプター、あるいは酵素と結合し、異なるシグナル伝達に関わる可能性を示唆する。
この二つのGoαの配列を比較した時、両者はalternative splicing variantである可能性が考えられるため、配列の異なる領域周辺でintronの有無を調べた。既知の各種G-proteinの情報をもとに、推定されるintronをはさむ領域でプライマーを設計しgenome上でPCRを行った。予想されるintronは確認されなかったことから、アゲハのGoαは、既知のG-proteinとは異なるgenome上の遺伝子構造を持つ可能性がある。このことを明らかにするために、今後、genome DNAよりGoαのクローニングを試みる。
また、アゲハ組織での二つのGoαの発現分布を調べるために、現在RT-PCRとin situ hybridizationに取り組んでいる。二つのGoαで、それぞれ発現部位と機能に相違があり、両者に役割分担があることがわかれば非常に興味深いと考えている。
考察
感覚毛に発現する遺伝子の網羅的な解析(EST解析)を目的に、全長cDNAライブラリーを調製したが、1Kbp以上のインサートは25%と少なく、満足できるものではない。調製に用いたRNA量も微量であるため解析数を1000に増やした段階で、cDNA調製に再検討を加える必要がある。インサートの配列決定を大量に行うために開発した簡便法は一定の評価ができるが、配列の精度、決定領域の長さ等、さらなる改良が必要である。
味覚レセプターの同定には、直接リガンドを決定することは現状では困難であり、遺伝子の発現部位の局在に頼らざるを得ない。そのためにはRT-PCR とin situ hybridization 法を確立することが急務である。その目的でおこなった神経細胞発現遺伝子、period 及びGoα遺伝子のクローニングは成功し、有効性が確認されている。特に、GoαはN端において5個のアミノ酸が異なる2種のパラログがみつかり、レセプターとの相互作用を研究するうえに貴重な知見を得たと評価できる。
アミン類がアゲハにおいて神経伝達物質と産卵刺激物質として異なる2種類の機能を持つことは非常に興味深い。最近哺乳類において中枢神経刺激物質でもあり旨味物質でもあるグルタミン酸がN端の長さのみが異なる共通のレセプターを使い分けていることが報告されている。アゲハにおいても、類似の遺伝子の使い回しによって、機能を多様化している可能性が考えられ、2種類のアミンレセプターのクローニングに成功したことが、アゲハの味覚研究に新しい切り口を開くことを期待している。
引用文献
1 Nishida R, Ohsugi T, Kokubo S, and Fukami H. (1987) Oviposition stimulants of a Citrus-feeding swallowtail butterfly, Papilio xuthus L. Experientia 43: 342-344.
2 Clyne PJ, Warr CG, Carlson JR. (2000) Candidate taste receptors in Drosophila. Science. 287:1830-1834.
3 Ishimoto H, Matsumoto A, Tanimura T. (2000) Molecular identification of a taste receptor gene for trehalose in Drosophila. Science. 289:116-119.
4 Ueno K, Ohta M, Morita H, Mikuni Y, Nakajima S, Yamamoto K, Isono K. (2001) Trehalose sensitivity in Drosophila correlates with mutations in and expression of the gustatory receptor gene Gr5a. Curr Biol. 11:1451-1455.
5 Kim J, Moriyama EN, Warr CG, Clyne PJ, Carlson JR. (2000) Identification of novel multi-transmembrane proteins from genomic databases using quasi-periodic structural properties. Bioinformatics. 16:767-775.
6 von Nickisch-Rosenegk E, Krieger J, Kubick S, Laage R, Strobel J, Strotmann J, Breer H. (1996) Cloning of biogenic amine receptors from moths (Bombyx mori and Heliothis virescens). Insect Biochem Mol Biol. 26:817-827.
7 Yoon J, Shortridge RD, Bloomquist BT, Schneuwly S, Perdew MH, Pak WL. (1989)
Molecular characterization of Drosophila gene encoding Go alpha subunit homolog.
J Biol Chem. 264:18536-18543.
