年度別活動報告
年度別活動報告書:2008年度
アゲハチョウの食草選択と進化
尾崎 克久(研究員) 中 秀司(奨励研究員)
廣崎 由利恵(研究補助員)
はじめに
化合物の認識は、外界の情報を知る手段として、全ての動物にとって不可欠な行動である。化合物の受容は味覚・嗅覚として認識され、寄主選択、配偶行動、集団生活の維持、社会性の構築など様々な場面で重要な役割を担っている。寄主選択において、化学受容の仕組みに変化が生じた場合、それまでとは異なる空間を生息の場として利用する集団が現れ、住み分けが何世代にもわたって繰り返されることによって種分化へとつながる。このような変化は、進化の歴史を物語る証拠としてゲノムに刻まれる。動物と環境との関わりにおいて中心的な機能である味覚や嗅覚といった化学受容に関わる分子機構の解明は、多様化、種分化、適応の仕組みを解明するために、最も有力な手がかりになると考えられる。
アゲハチョウの仲間は、他の多くの植食性昆虫と同様に、特定の植物のみを餌として利用する単食性に近い寄主選択をしており、寄主選択とアゲハチョウ科の進化には相関関係が認められる1)。卵から孵化したばかりのアゲハチョウの幼虫は、体が小さく移動能力が低いため、自力で餌を探索することは困難である。メス成虫による正確な植物種の識別と産卵場所の選択は、次世代の生存を左右する重要な役割である。メス成虫は産卵の直前に前脚で植物に触れることで含有する化合物を感じ取り、その組み合わせによって産卵行動が引き起こされる。ナミアゲハ(Papilio xuthus)では、ウンシュウミカンの葉から産卵刺激物質として10種類の化合物が単離されている2)。他にも数種のアゲハ類で産卵刺激物質が明らかにされており、これらの構造について、アゲハ種間で比較すると類似性が認められる。このことから、植物の系統的近縁性とは無関係に、植物に含まれている化合物の類似性が寄主転換の可能性を支え、食性の進化を可能にしたのではないかと考えられている3)。これまでに報告されている産卵刺激物質は全て不揮発性であるため、アゲハチョウは前脚で「味」として認識していると考えられている。前脚での味の感じ方に変化が生じた場合、それまでとは異なる植物を選択する集団が現れて、住み分けによる隔離を出発点とする同所的種分化という現象を引き起こしたと考えられる。
ミカン科食性のアゲハチョウ間であっても、種ごとに産卵刺激物質として認識する化合物の組み合わせが異なるため、種ごとに特徴的な多様な味覚受容体を持っていることが予測される。また、味覚受容体が化合物を認識するためには、化合物が化学感覚毛内のリンパ液を通り抜けて受容体に到達する必要があるため、化合物を結合して運搬する役割を持つタンパクが必要になると考えられる。味覚受容体と化合物結合タンパクを中心とする産卵刺激物質受容システムに関わる遺伝子群を解明し、複数種間で比較することができれば、食草転換を原動力として起きた進化という現象のメカニズムを理解する重要な手がかりになると考えた。
昆虫の味覚に関する研究が本格的に始まったのは20年以上前に遡るが4)、味覚受容体は2000年になって初めて7回膜貫通型受容体(以下7TMRと略)が報告された5)。化学受容の7TMRは一次構造の多様性が高く、脊椎動物から報告されている味覚・嗅覚の7TMRに対する類似性を手がかりとした探索は困難であり、ショウジョウバエの全ゲノム配列の情報科学的解析によって候補遺伝子ファミリーが同定された。昆虫の味覚受容体は極端に発現量が少ないため解析は困難を極め、直接的な証拠によって機能が解明されているものはまだ少ない6),7)。化合物結合タンパクについて、味覚器官で発現するものが見つかっており8)、食草の選択に重要な役割を持つものも報告されている9)。また、多種昆虫から化合物結合タンパクの遺伝子が報告され、情報が蓄積しつつある。
本研究は、主たる食草の産卵刺激物質が明らかにされているナミアゲハとシロオビアゲハを材料として用い、メス成虫前脚ふ節に発現する味覚受容体遺伝子及び化合物結合タンパク遺伝子をクローニングし、その機能と特徴の解明を目的として取り組んでいる。初年度(2001年)はナミアゲハメス成虫前脚ふ節からcDNAライブラリーを調製し、大量塩基配列決定方法とRT-PCRによる発現部位決定法を確立した。2002年度はナミアゲハメス成虫前脚ふ節cDNAライブラリーの網羅的な塩基配列決定及び、得られた配列の情報解析、発現解析を行った。その結果、ふ節に特異的に発現する7TMRであるPXFT-01989、ふ節で発現する11種類の化合物結合タンパク(chemosensory protein: CSP)、ふ節で発現する3種のアミンレセプター及び1種類のチトクロームp450の遺伝子をクローニングした10)。2003年度はFosmidベクターを用いてナミアゲハゲノムライブラリーを作製し、既に得られた上記候補遺伝子をプローブとして、ゲノム上の遺伝子の全構造と関連遺伝子ファミリーのクローニングを行った。2004年度は、ふ節に特異的に発現する7TMR遺伝子であるPXFT-01989から、選択的スプライシングによって少なくとも4種類のメッセンジャーRNAが作られていることを発見した。また、PXFT-01989遺伝子を手がかりとして、他のアゲハチョウから7TMR遺伝子を探索した結果、シロオビアゲハから類似性の高い部分配列を発見した。複数の7TMR遺伝子の発見を目的として、シロオビアゲハのメス成虫ふ節の完全長cDNAライブラリーを作成した。2005年度は、バキュロウイルスベクターを用いて培養昆虫細胞中でPXFT-01989遺伝子を発現させ、カルシウムイメージング法を用いて化合物への応答について解析を行い、PXFT-01989遺伝子が産卵刺激物質の一つであるシネフリン(synephrine)の受容体である可能性を示唆する結果を得た。また、シロオビアゲハのcDNAライブラリーの解析で見つかったCSPファミリーについてナミアゲハと比較することでこの遺伝子ファミリーの進化について考察した。2006年度は、公的なデータベースに登録されている昆虫化学受容体の配列を収集し、最尤法による系統解析を行った結果、化学受容体が味覚と嗅覚の2グループに大別され、PXFT-01989が味覚グループに属することを確認し、PxutGr1と名付けた。また、PxutGr1が、シネフリンに対する応答の強さが濃度依存的に上昇することを確認した。2007年度は、PxutGr1遺伝子の成熟過程における生体内での発現量の変化を調べ、産卵行動の活性との関連性を考察した。シロオビアゲハから見つかったPxutGr1ホモログ遺伝子の全長配列を決定し、ゲノム構造を調査した。また、CSP遺伝子がゲノム上の特定の領域にクラスターしており11)、その構造がカイコと類似していることを発見した。
本年度は、培養昆虫細胞のシネフリンへの応答が、異所的に発現させたPxutGr1によって獲得した機能であることを証明することを目的に、PxutGr1の機能阻害に取り組み、シネフリンで刺激したときの強い応答が消失することを確認した。
結果と考察
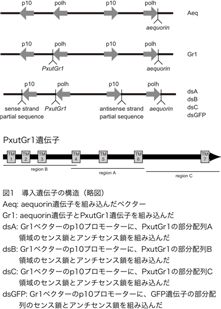
本研究では、バキュロウイルスを用いて、培養昆虫細胞Sf9で外来遺伝子を発現させている。バキュロウイルスに遺伝子を導入するために用いているベクターには、昆虫細胞内で高い発現レベルを示すことで知られているポリヘドリン遺伝子とp10遺伝子のプロモーターが各2つ、計4つ組み込まれているものを利用している(図1)。これにより、同時に最大4種類の遺伝子の導入と発現が可能となる。以後、導入した遺伝子の組み合わせにより、 作成したウイルスをAeq(ポリヘドリンプロモーターの一つにaequorin遺伝子を組み込んだ)、Gr1(2つあるポリヘドリンプロモーターの一つにaequorin遺伝子、もう一つにPxutGr1遺伝子を組み込んだ)、dsA(Gr1ウイルスのp10プロモーターに、PxutGr1の部分配列A領域のセンス鎖とアンチセンス鎖約400塩基を追加)、dsB(Gr1ウイルスのp10プロモーターに、PxutGr1の部分配列B領域のセンス鎖とアンチセンス鎖約400塩基を追加)、dsC(Gr1ウイルスのp10プロモーターに、PxutGr1の部分配列C領域のセンス鎖とアンチセンス鎖約400塩基を追加)、dsGFP(Gr1ウイルスのp10プロモーターに、GFP遺伝子部分配列のセンス鎖とアンチセンス鎖約400塩基を追加)と呼ぶ(図1)。dsA、dsB、dsCではPxutGr1遺伝子の機能が阻害され、シネフリンによる刺激に対する応答が消失し、dsGFPでは、PxutGr1遺伝子の機能には影響が出ないことが期待される。RT-PCRにより、導入した各遺伝子の発現を確認した結果、Gr1ウイルスの場合はPxutGr1とaequorinがほぼ同レベル、dsAウイルスではPxutGr1が検出感度以下に発現量が低下していることを確認できた(図2)。

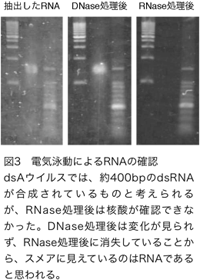
dsBとdsCについても同様の結果が得られていることから、p10プロモーターに組み込んだ部分配列が期待どおりにPxutGr1遺伝子の発現を阻害しているものと考えられる。dsAウイルスを感染させた培養昆虫細胞からRNAを抽出し、dsRNAの検出を試みた結果、dsRNAは確認することができなかった(図3)。培養昆虫細胞からRNA抽出を行った後、DNase処理を行っても泳動パターンには変化が無く、RNase処理を行った場合にはスメアに見えていた核酸が消失していることから、一本鎖のRNAであったと思われる。p10プロモーターに組み込んだ部分配列からdsRNAが合成された場合、約400bpになると期待されるが、その移動度の核酸は検出できなかった。この結果は、期待どおりにdsRNAが合成されていたとしても、RNA干渉の仕組みによってプロセッシングを受けるため、電気泳動では検出できないことを示唆していると考えられる。dsAウイルスを感染させた培養昆虫細胞からRNAを抽出し、dsRNAの検出を試みた結果、dsRNAは確認することができなかった(図3)。培養昆虫細胞からRNA抽出を行った後、DNase処理を行っても泳動パターンには変化が無く、RNase処理を行った場合にはスメアに見えていた核酸が消失していることから、一本鎖のRNAであったと思われる。p10プロモーターに組み込んだ部分配列からdsRNAが合成された場合、約400bpになると期待されるが、その移動度の核酸は検出できなかった。この結果は、期待どおりにdsRNAが合成されていたとしても、RNA干渉の仕組みによってプロセッシングを受けるため、電気泳動では検出できないことを示唆していると考えられる。
カルシウムイメージング法による応答の確認
微弱発光計測装置を用いたカルシウムイメージング法により、作成したウイルスを感染させた場合のシネフリン溶液に対する培養昆虫細胞の応答を観察した(図4)。
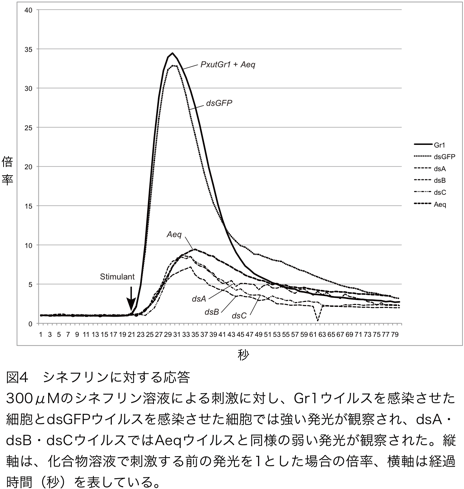 |
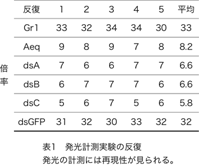
これまでの実験で、化合物溶液による刺激を行う前の発光を1として、刺激を行ったときに起きる変化を倍率として表すと、300μMのシネフリン溶液での刺激でPxutGr1を発現させた細胞では30倍を超える強い発光が観察されるのに対し、aequorinのみを発現させた細胞では10倍未満の弱い発光が観察されている。同じ条件で、PxutGr1部分配列のdsRNAを合成する3種類のウイルス(dsA・dsB・dsC)を感染させた細胞では、aequorinのみを発現する細胞と同程度の弱い発光が観察された。この結果は、合成されたdsRNAにより、PxutGr1の機能が阻害されたためであると考えられる。機能の阻害に用いる領域は、3カ所のどこを用いても同様の効果があることが明らかになった。反対に、PxutGr1とは機能的に無関係であるGFPのdsRNAを合成するウイルスを感染させた細胞では、PxutGr1を発現する細胞と同様に強い発光が観察された。この結果は、GFP遺伝子の部分配列のdsRNAが合成されても、PxutGr1の機能には影響が無いことを示している。これら発光計測実験には再現性が認められた(表1)。以上の結果から、シネフリン溶液で刺激を行った場合に観察されるGr1ウイルス感染細胞の強い発光は、PxutGr1遺伝子を発現したことによって獲得した機能であると考えられる。このことから、PxutGr1遺伝子は、カルシウムをカスケードとする場合にはナミアゲハの産卵刺激物質の一つであるシネフリンを認識する機能を持つ受容体であることが証明できたと考える。
おわりに
ナミアゲハから発見した7TMRであるPxutGr1が、産卵刺激物質の一つであるシネフリンに反応することは以前にも報告しているが、PxutGr1を発現していないSf9細胞でもシネフリン溶液の刺激によって弱い発光が観察されていたため、強い発光がPxutGr1の発現によって獲得した機能であることを証明する必要が生じ、リガンドの特定が難航していた。今年度は、バキュロウイルスに導入できる4プロモーター全てを活用し、PxutGr1の発現と同時に部分配列のdsRNAを合成させ機能を阻害するという類例のないアイデアに取り組み、上述の結果が得られた。PxutGr1の発現による発光は、ウイルス感染後48時間後にはある程度観察できるが、最大の発光を計測できるのは72時間から96時間ほど経過した頃になる。PxutGr1遺伝子の発現に用いているプロモーターは、バキュロウイルスのポリヘドリン遺伝子に由来するが、ポリヘドリン遺伝子の発現はウイルス感染後期に最大となる特性が影響している可能性が考えられる。dsRNAを合成するウイルスを感染させた細胞は、それ以外のウイルス(Gr1・Aeq)を感染させた細胞に比べて死亡する時期が早まる傾向が見られるが、発光が最大となる時期にはほとんど変化が見られないため、実験に適した時期の見極めが難しい。そのため、これまでのバキュロウイルスと培養昆虫細胞を用いた実験の経験が、大いに活かされることとなった。4つのプロモーター全てを使うことで細胞の死亡時期を早める影響があるのであれば、機能阻害のために組み込む部分配列はアンチセンス鎖のみとすることで改善できる可能性がある。今年度の取り組みでは、dsRNA合成用にセンス鎖部分配列とアンチセンス鎖部分配列の両方を導入したが、アンチセンス鎖のみでも機能阻害の効果を発揮することに期待できると思われる。
今年度の取り組みにより、PxutGr1がカルシウムカスケードにおいてはシネフリンをリガンドとする受容体であることが証明できたのではないかと思われる。今後の取り組みとして、実際に産卵行動に関与するか否かを解明するため、生体内での機能解析に取り組む必要があるだろう。
謝辞
本研究の遂行にあたり、九州大学の谷村禎一准教授・石元広志博士には多大なご協力を頂いた。
参考文献
1 Thompson J. N. (1988) Evolutionary genetics of oviposition preference in swallowtail butterflies. Evolution 42: 1223-1234.
2 Nishida R, Ohsugi T, Kokubo S, and Fukami H. (1987) Oviposition stimulants of a Citrus-feeding swallowtail butterfly, Papilio xuthus L. Experientia 43:342-344.
3 Feeny, P. (1995) Ecological opportunism and chemical constraints on the host associations of swallowtail butterflies, pp. 9-15 in J. M. Scriber, Y. Tsubaki, and R. C. Lederhouse (eds.). Swallowtail Butterflies: Their Ecology and Evolutionary Biology. Scientific Publishers, Gainesville, Florida.
4 Tanimura, T., Isono, K., Takamura, T., and Shimada, I. (1982). Genetic dimorphism in the taste sensitivity to trehalose in Drosophila melanogaster. J. Comp. Physiol. 141, 433-437.
5 Clyne PJ, Warr CG, Carlson JR. (2000) Candidate taste receptors in Drosophila. Science. 287:1830-1834.
6 Chyb, S., Dahanukar, A., Wickens, A., and Carlson, J.R. (2003). Drosophila Gr5a encodes a taste receptor tuned to trehalose. Proc. Natl. Acad. Sci. USA 100 (Suppl 2), 14526-14530.
7 Jones, W. D., Cayirlioglu, P., Kadow, I. G. and Vosshall, L. B. (2007) Two chemosensory receptors together mediate carbon dioxide detection in Drosophila nature. 445: 86-90
8 Galindo K, Smith DP. (2001) A large family of divergent Drosophila odorant-binding proteins expressed in gustatory and olfactory sensilla. Genetics. 159:1059-1072.
9 Matsuo T, Sugaya S, Yasukawa J, Aigaki T, Fuyama Y. 2007. Odorant-binding proteins OBP57d and OBP57e affect taste perception and host-plant preference in Drosophila sechellia. PLoS Biol, 5: e118.
10 Ono H., Ozaki K. and Yoshikawa H. (2005) Identification of cytochrome P450 and glutathione-S-transferase genes preferentially expressed in chemosensory organs of the swallowtail butterfly, Papilio xuthus L. Insect Biochem. Mol. Biol., 35: 837-846.
11 Ozaki K., Utoguchi A., Yamada A. and Yoshikawa H. (2008) Identification and genomic structure of chemosensory proteins (CSP) and odorant binding proteins (OBP) genes expressed in foreleg tarsi of the swallowtail butterfly Papilio xuthus. Insect Biochem. Mol. Biol., 38: 969-976
